摘要:对于难溶化合物AgCl来说.一定温度下.当其在水中达到溶解平衡时.银离子浓度与氯离子浓度之积是一个常数.叫做溶度积常数.用Ksp表示.即 Ksp=c(Ag+)·c(Cl-).一定温度下.分别把 1 g AgCl 固体放于下列各不同溶液里.充分搅拌使其达到溶解平衡后.剩余固体质量最大的是( ) A.20 mL 0.1 mol/LKCl溶液 B.20 mL 0.1 mol /L MgCl2溶液 C.20 mL 0.2 mol /L CaCl2溶液 D.20 mL 0.15 mol /L AlCl3溶液
网址:http://m.1010jiajiao.com/timu3_id_295987[举报]
难溶化合物的饱和溶液存在溶解平衡,例如:AgCl(s) Ag++Cl-,Ag2CrO4(s)
Ag++Cl-,Ag2CrO4(s)  2Ag++CrO42-.在一定温度下,已知:Ksp(AgCl)=c(Ag+)?c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2?c(+CrO42-)=1.9×10-12,现用0.01mol?L-1 AgNO3溶液滴定0.01mol?L-1 KCl和0.001mol?L-1 K2CrO4混合溶液,通过计算回答:
2Ag++CrO42-.在一定温度下,已知:Ksp(AgCl)=c(Ag+)?c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2?c(+CrO42-)=1.9×10-12,现用0.01mol?L-1 AgNO3溶液滴定0.01mol?L-1 KCl和0.001mol?L-1 K2CrO4混合溶液,通过计算回答:
(1)Cl-、CrO42-谁先沉淀?
(2)当刚出现Ag2CrO4沉淀时,溶液中Cl-的物质的量浓度是多少?(设混合溶液在反应中体积不变)
查看习题详情和答案>>
 Ag++Cl-,Ag2CrO4(s)
Ag++Cl-,Ag2CrO4(s)  2Ag++CrO42-.在一定温度下,已知:Ksp(AgCl)=c(Ag+)?c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2?c(+CrO42-)=1.9×10-12,现用0.01mol?L-1 AgNO3溶液滴定0.01mol?L-1 KCl和0.001mol?L-1 K2CrO4混合溶液,通过计算回答:
2Ag++CrO42-.在一定温度下,已知:Ksp(AgCl)=c(Ag+)?c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2?c(+CrO42-)=1.9×10-12,现用0.01mol?L-1 AgNO3溶液滴定0.01mol?L-1 KCl和0.001mol?L-1 K2CrO4混合溶液,通过计算回答:(1)Cl-、CrO42-谁先沉淀?
(2)当刚出现Ag2CrO4沉淀时,溶液中Cl-的物质的量浓度是多少?(设混合溶液在反应中体积不变)
(2012?浦东新区二模)铬铁矿的主要成分可表示为FeO?Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
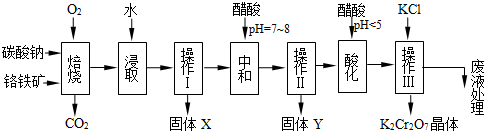
已知:
①4FeO?Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3
2NaAlO2+CO2↑;
③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有
(2)酸化步骤用醋酸调节溶液pH<5,其目的是
物质溶解度/(g/100g水)0°C40°C80°CKCl2840.151.3NaCl35.736.438K2Cr2O74.726.373Na2Cr2O7163215376
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、
(4)表格是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
该反应在溶液中能发生的理由是
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量
(用含m、n的代数式表示).
(6)六价铬有毒,而Cr3+相对安全.工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3.在实验室中模拟这一过程的装置如下:
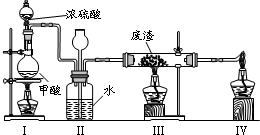
CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是
查看习题详情和答案>>

已知:
①4FeO?Cr2O3+8Na2CO3+7O2
| 750℃ |
②Na2CO3+Al2O3
| 750℃ |
③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有
Fe2O3、MgO
Fe2O3、MgO
(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用pH计或精密pH试纸
pH计或精密pH试纸
(填写仪器或试剂名称).(2)酸化步骤用醋酸调节溶液pH<5,其目的是
使CrO42-转化为Cr2O72-
使CrO42-转化为Cr2O72-
.物质溶解度/(g/100g水)0°C40°C80°CKCl2840.151.3NaCl35.736.438K2Cr2O74.726.373Na2Cr2O7163215376
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、
冷却结晶
冷却结晶
、过滤、洗涤
洗涤
、干燥.(4)表格是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
该反应在溶液中能发生的理由是
K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).
K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).
.
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
NaOH溶液
NaOH溶液
(填写试剂)、溶解、过滤、再通入过量二氧化碳
通入过量二氧化碳
(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为| 26m |
| 17n |
| 26m |
| 17n |
(6)六价铬有毒,而Cr3+相对安全.工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3.在实验室中模拟这一过程的装置如下:

CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是
III、I、IV
III、I、IV
.(2013?临沭县模拟)镉离子(Cd2+)是重金属冶炼工业污水中的一种离子.处理含镉废水常用化学沉淀法.回答下面的问题.
(1)以下是几种镉的难溶化合物的溶度积常数(25℃):
根据上表提供的信息判断,沉淀Cd2+效果最佳的试剂是
a.Na2CO3 b.Na2S c.CaO
(2)如图1所示为某化工厂处理含Cd2+废水的流程:
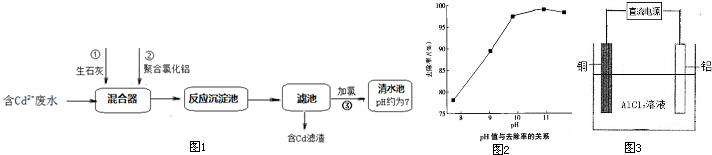
①写出加入生石灰后发生反应的离子方程式:
②聚合氯化铝[Al2(OH)nClx-n]是一种无机高分子聚合物,分子式中x=
③如图2是随污水的pH升高Cd2+去除率的变化图象,由图象可知,处理含Cd2+污水的最佳pH=
(3)在特定的电解槽中,用铝、铜作电极,氯化铝作电解液,制备聚合氯化铝(示意图如图3),电解反应为:Al+H2O+AlCl3
[Al2(OH)nClx-n]+H2
①铝作电解池的
②该电解池的阴极电极反应为
查看习题详情和答案>>
(1)以下是几种镉的难溶化合物的溶度积常数(25℃):
| 含镉难溶物 | CdCO3 | CdS | Cd(OH)2 |
| 溶度积常数 | 5.2×10-12 | 3.6×10-29 | 2.0×10-16 |
b
b
a.Na2CO3 b.Na2S c.CaO
(2)如图1所示为某化工厂处理含Cd2+废水的流程:

①写出加入生石灰后发生反应的离子方程式:
CaO+H2O=Ca2++2OH-、Cd2++2OH-=Cd(OH)2↓
CaO+H2O=Ca2++2OH-、Cd2++2OH-=Cd(OH)2↓
.②聚合氯化铝[Al2(OH)nClx-n]是一种无机高分子聚合物,分子式中x=
6
6
.③如图2是随污水的pH升高Cd2+去除率的变化图象,由图象可知,处理含Cd2+污水的最佳pH=
11
11
(取正整数),此时溶液中c(Cd2+)=2.0×10-10 mol?L-1
2.0×10-10 mol?L-1
.(3)在特定的电解槽中,用铝、铜作电极,氯化铝作电解液,制备聚合氯化铝(示意图如图3),电解反应为:Al+H2O+AlCl3
| 通电 |
①铝作电解池的
阳
阳
(填“阴”或“阳”)极.②该电解池的阴极电极反应为
2H++2e-=H2↑
2H++2e-=H2↑
.