题目内容
(2013?临沭县模拟)镉离子(Cd2+)是重金属冶炼工业污水中的一种离子.处理含镉废水常用化学沉淀法.回答下面的问题.
(1)以下是几种镉的难溶化合物的溶度积常数(25℃):
根据上表提供的信息判断,沉淀Cd2+效果最佳的试剂是
a.Na2CO3 b.Na2S c.CaO
(2)如图1所示为某化工厂处理含Cd2+废水的流程:
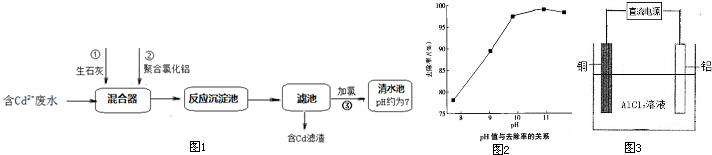
①写出加入生石灰后发生反应的离子方程式:
②聚合氯化铝[Al2(OH)nClx-n]是一种无机高分子聚合物,分子式中x=
③如图2是随污水的pH升高Cd2+去除率的变化图象,由图象可知,处理含Cd2+污水的最佳pH=
(3)在特定的电解槽中,用铝、铜作电极,氯化铝作电解液,制备聚合氯化铝(示意图如图3),电解反应为:Al+H2O+AlCl3
[Al2(OH)nClx-n]+H2
①铝作电解池的
②该电解池的阴极电极反应为
(1)以下是几种镉的难溶化合物的溶度积常数(25℃):
| 含镉难溶物 | CdCO3 | CdS | Cd(OH)2 |
| 溶度积常数 | 5.2×10-12 | 3.6×10-29 | 2.0×10-16 |
b
b
a.Na2CO3 b.Na2S c.CaO
(2)如图1所示为某化工厂处理含Cd2+废水的流程:

①写出加入生石灰后发生反应的离子方程式:
CaO+H2O=Ca2++2OH-、Cd2++2OH-=Cd(OH)2↓
CaO+H2O=Ca2++2OH-、Cd2++2OH-=Cd(OH)2↓
.②聚合氯化铝[Al2(OH)nClx-n]是一种无机高分子聚合物,分子式中x=
6
6
.③如图2是随污水的pH升高Cd2+去除率的变化图象,由图象可知,处理含Cd2+污水的最佳pH=
11
11
(取正整数),此时溶液中c(Cd2+)=2.0×10-10 mol?L-1
2.0×10-10 mol?L-1
.(3)在特定的电解槽中,用铝、铜作电极,氯化铝作电解液,制备聚合氯化铝(示意图如图3),电解反应为:Al+H2O+AlCl3
| 通电 |
①铝作电解池的
阳
阳
(填“阴”或“阳”)极.②该电解池的阴极电极反应为
2H++2e-=H2↑
2H++2e-=H2↑
.分析:(1)根据溶度积常数大小分析,Ksp越小,溶解度越小,沉淀越完全;
(2)①加入CaO后,CaO先与水反应,产物再与Cd2+反应;
②根据化合物中元素的化合价分析;
③根据图象可知PH=11时Cd2+去除率最大;根据Ksp计算;
(3)①电解槽中Al参加反应失电子,作阳极,②阴极是溶液中的阳离子得电子,即2H++2e-=H2↑.
(2)①加入CaO后,CaO先与水反应,产物再与Cd2+反应;
②根据化合物中元素的化合价分析;
③根据图象可知PH=11时Cd2+去除率最大;根据Ksp计算;
(3)①电解槽中Al参加反应失电子,作阳极,②阴极是溶液中的阳离子得电子,即2H++2e-=H2↑.
解答:解:(1)根据溶度积常数大小分析,Ksp越小,溶解度越小,沉淀越完全,由表格可知CdS的Ksp最小,所以应选Na2S作沉淀剂,故答案为:b;
(2)①加入CaO后,CaO先与水反应,产物再与Cd2+反应其反应方程为:CaO+H2O=Ca2++2OH-、Cd2++2OH-=Cd(OH)2↓,
故答案为:CaO+H2O=Ca2++2OH-、Cd2++2OH-=Cd(OH)2↓;
②根据化合物中元素的化合价分析,化合物中元素化合价的代数和为零,则n×(-1)+(x-n)×(-1)+2×3=0,所以x=6,故答案为:6;
③根据图象可知PH=11时Cd2+去除率最大;根据Ksp=c(Cd2+)?c2(OH-)=2.0×10-16,已知c(OH-)=10-3,则c(Cd2+)=2.0×10-10 mol?L-1,
故答案为:11;2.0×10-10 mol?L-1;
(3)①电解槽中Al参加反应失电子,所以Al作阳极,故答案为:Al;
②阴极是溶液中的阳离子得电子,即氢离子得电子,其电极方程为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑.
(2)①加入CaO后,CaO先与水反应,产物再与Cd2+反应其反应方程为:CaO+H2O=Ca2++2OH-、Cd2++2OH-=Cd(OH)2↓,
故答案为:CaO+H2O=Ca2++2OH-、Cd2++2OH-=Cd(OH)2↓;
②根据化合物中元素的化合价分析,化合物中元素化合价的代数和为零,则n×(-1)+(x-n)×(-1)+2×3=0,所以x=6,故答案为:6;
③根据图象可知PH=11时Cd2+去除率最大;根据Ksp=c(Cd2+)?c2(OH-)=2.0×10-16,已知c(OH-)=10-3,则c(Cd2+)=2.0×10-10 mol?L-1,
故答案为:11;2.0×10-10 mol?L-1;
(3)①电解槽中Al参加反应失电子,所以Al作阳极,故答案为:Al;
②阴极是溶液中的阳离子得电子,即氢离子得电子,其电极方程为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑.
点评:本题主要考查了镉及其化合物的性质,以及Ksp应用和计算、电解池等知识,难度中等,抓住题目信息是解题的关键.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
 (2013?临沭县模拟)硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥等.某温度时,HgS在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
(2013?临沭县模拟)硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥等.某温度时,HgS在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
 (R、R′可以是烃基或H原子)
(R、R′可以是烃基或H原子)

