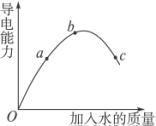
摘要:在一定温度下.冰醋酸加水稀释过程中.溶液的导电能力如右图所示.请回答: (1)“O 点导电能力为“0 的理由是 . (2)A.B.C三点pH值由大到小的顺序是 . (3)A.B.C三点电离程度最大的是
网址:http://m.1010jiajiao.com/timu3_id_294530[举报]
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:(1)“O”点导电能力为0的理由是
在“O”点处醋酸未电离,无离子存在
在“O”点处醋酸未电离,无离子存在
;(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为
c<a<b
c<a<b
;(3)a、b、c三点处,电离程度最大的是
c
c
;(4)若使c(CH3COO-)增大,溶液c(H+)减小,可采取的措施是:①
加少量NaOH固体
加少量NaOH固体
;②加少量Na2CO3固体
加少量Na2CO3固体
;③加入Zn、Mg等金属
加入Zn、Mg等金属
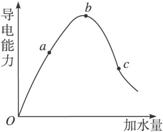
. 在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:(1)写出醋酸的电离方程式
CH3COOH?CH3COO-+H+
CH3COOH?CH3COO-+H+
.(2)a、b、c三点溶液中氢离子浓度由小到大的顺序为
b>a>c
b>a>c
.(3)a、b、c三点中醋酸的电离程度最大的是
C
C
.(4)取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲
<
<
10C(H+)乙(填“大于”、“小于”或“等于”)甲,其原因是:醋酸溶液越稀电离程度越大
醋酸溶液越稀电离程度越大
. 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )