题目内容
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如下图所示,请回答: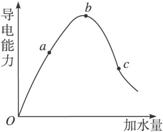
(1)“O”点导电能力为0的理由________________。
(2)a、b、c三点溶液的pH由小到大的顺序为__________________。
(3)a、b、c三点中电离度最大的是___________________________。
(4)若使c点溶液的c(CH3COO-)增大,溶液的pH也增大,可采取的措施为①____________________;②____________________。
解析:未加水时,醋酸不能电离,故无离子,不能导电,开始加水稀释时,电离度增大,c(H+)增大,b点CH3COOH恰好全部溶解并达到电离平衡,此时c(H+)最大,pH最小。再加水,CH3COOH电解平衡右移,电离度增大,c(H+)减小,pH增大。要使c点的c(CH3COO-)增大,pH增大,加入碱,如NaOH,也可以加入CH3COONa溶液。
答案:(1)纯CH3COOH不电离,无自由移动离子
(2)bac
(3)c
(4)①加NaOH ②加CH3COONa

(14分)、根据电离平衡移动原理完成下列表格
(1)已知:CH3COOH为弱电解质,在醋酸溶液中,当改变条件后,完成表格中的变化情况
| 外加条件 | 平衡移动方向 | C(OH -) | C(CH3COO -) |
| 升温 |
| 不填 | 不填 |
| 加水 |
|
| 不填 |
| 加盐酸 | 不填 |
|
|
| 加少量氢氧化钠固体 | 不填 | 不填 |
|
(2)在一定温度下,冰醋酸加水稀释过中溶液的导电能力如下图所示,请回答:
①写出醋酸的电离方程式________________。
②a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________。
③a、b、c三点中醋酸的电离程度最大的是 。
④取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲_____10C(H+)乙(填“大于”、“小于”或 “等于”),
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答: 在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答: 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )