网址:http://m.1010jiajiao.com/timu3_id_293681[举报]
 CO(g)+H2(g)△H=+131kJ?mol-1
CO(g)+H2(g)△H=+131kJ?mol-1(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器 编号 |
c(H2O) /mol?L-1 |
c(CO) /mol?L-1 |
c(H2) /mol?L-1 |
v正、v逆比较 |
| I | 0.06 | 0.60 | 0.10 | v正=v逆 |
| II | 0.06 | 0.50 | 0.40 | ① |
| III | 0.12 | 0.40 | 0.80 | v正<v逆 |
| IV | 0.12 | 0.30 | ② | v正=v逆 |
(3)在一定条件下用水煤气能合成甲醇:CO(g)+2H2(g)
 CH3OH(g) 据研究,给合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示)
CH3OH(g) 据研究,给合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示) 2Cu+CO2
2Cu+CO2 2Cu+CO2
2Cu+CO2(4)熔融盐燃料电池具有高的发电效率,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,其中一极通入CO,另一极通入空气和CO2的混合气体.根据上述信息,该燃料电池:负极反应式为
 哥本哈根会议虽未能就减排问题达成有约束力的协议,但各国对于CO2对气候的影响达成了共识,都在积极研究方法循环利用CO2.CO2(g)与H2(g)反应可生成CH3OH(g)和H2O(g).某实验小组为研究该反应进行了如下实验.在某温度下,向容积为10L的恒温恒容容器中充入a mol CO2和a mol H2,测得不同时刻的c(H2)如右表.
哥本哈根会议虽未能就减排问题达成有约束力的协议,但各国对于CO2对气候的影响达成了共识,都在积极研究方法循环利用CO2.CO2(g)与H2(g)反应可生成CH3OH(g)和H2O(g).某实验小组为研究该反应进行了如下实验.在某温度下,向容积为10L的恒温恒容容器中充入a mol CO2和a mol H2,测得不同时刻的c(H2)如右表.| 时间/min | C(H2)/mol.L-1 |
| 0 | 0.40 |
| 2 | 0.28 |
| 4 | 0.19 |
| 6 | 0.13 |
| 8 | 0.08 |
| 10 | 0.04 |
| 12 | 0.04 |
 CH3OH+H2O
CH3OH+H2O CH3OH+H2O
CH3OH+H2O(2)下列措施能使平衡体系中
| c(CH3OH) |
| c(CO2) |
A、升高温度 B、充入Ar使压强增大
C、再充入0.5a mol CO2和0.5a mol H2D、将水从平衡体系中分离出来
(3)a=
(4)在如图所示的坐标系中,画出CO2和H2的浓度随时间变化的图象.
| 时间/min | C(H2)/mol.L-1 |
| 0 | 0.40 |
| 2 | 0.28 |
| 4 | 0.19 |
| 6 | 0.13 |
| 8 | 0.08 |
| 10 | 0.04 |
| 12 | 0.04 |
(2)下列措施能使平衡体系中
| c(CH3OH) |
| c(CO2) |
A、升高温度 B、充入Ar使压强增大
C、再充入0.5a mol CO2和0.5a mol H2D、将水从平衡体系中分离出来
(3)a=______,该温度下上述反应的平衡常数K=______(精确到0.1).
(4)在如图所示的坐标系中,画出CO2和H2的浓度随时间变化的图象.
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g) ![]() CO (g) +H2 (g) △H = +131.3 kJ•mol-1
CO (g) +H2 (g) △H = +131.3 kJ•mol-1
(1)该反应的平衡常数K随温度的升高而___________(增大 / 减小 / 不变)。
 (2)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
(2)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
① 缩小容器体积(用实线表示)
② 降低温度(用虚线表示)
(3)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
| 容器编号 | c(H2O)/mol·L-1 | c(CO)/mol·L-1 | c(H2)/mol·L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ________ | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正____ν逆 |
(4)己知:2C (s) + O2(g) = 2CO (g) △H = -221.0 kJ·mo1-1
2CO(g) + O2(g) = 2CO2 (g) △H = -566.0 kJ·mo1-1
2H2 (g) + O2 (g) = 2H2O (g) △H = -483.6 kJ·mo1-1
若将24g炭完全转化为水煤气,然后再充分燃烧,整个过程的焓变为△H = kJ/mol。
查看习题详情和答案>>在一容积为4 L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下,发生如下反应:
N2(g)+3H2(g)![]() 2NH3(g ) △H<0 ,
2NH3(g ) △H<0 ,
反应中NH3的物质的量浓度变化情况如右图:
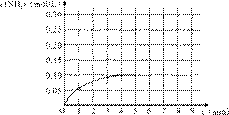
(1)根据上图,计算从反应开始到平衡时,平
均反应速率v(NH3)为______mol/(L·min)。
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为___________。
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d. 0.08 mol/L
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡___________________移动(填“向逆反应方向”、“向正反应方向”或“不”)。
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
(5)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
(A)图Ⅰ可能是不同压强对反应的影响,且P2>P1
(B)图Ⅱ可能是不同压强对反应的影响,且P1>P2
(C)图Ⅲ可能是不同温度对反应的影响,且T1>T2
(D)图Ⅱ可能是同温同压下,催化剂性能对反应的影响,且1>2
查看习题详情和答案>>