题目内容
 CO(g)+H2(g)△H=+131kJ?mol-1
CO(g)+H2(g)△H=+131kJ?mol-1(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器 编号 |
c(H2O) /mol?L-1 |
c(CO) /mol?L-1 |
c(H2) /mol?L-1 |
v正、v逆比较 |
| I | 0.06 | 0.60 | 0.10 | v正=v逆 |
| II | 0.06 | 0.50 | 0.40 | ① |
| III | 0.12 | 0.40 | 0.80 | v正<v逆 |
| IV | 0.12 | 0.30 | ② | v正=v逆 |
(3)在一定条件下用水煤气能合成甲醇:CO(g)+2H2(g)
 CH3OH(g) 据研究,给合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示)
CH3OH(g) 据研究,给合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示) 2Cu+CO2
2Cu+CO2 2Cu+CO2
2Cu+CO2(4)熔融盐燃料电池具有高的发电效率,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,其中一极通入CO,另一极通入空气和CO2的混合气体.根据上述信息,该燃料电池:负极反应式为
| 0.1×0.6 |
| 0.06 |
(2)利用三段式法计算,固体对反应速率和化学平衡都没有影响,加入碳粉,水蒸气的转化率不变;
(3)Cu2O能被CO还原生成CO2和Cu,该反应为可逆反应;
(4)通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-=4CO2,通入空气和CO2的混合气体一极为原电池的正极,发生还原反应,
电极反应式为O2+4e-+2CO2=2CO32-.
| 0.1×0.6 |
| 0.06 |
| 0.5×0.4 |
| 0,06 |
反应Ⅳv正=v逆,说明反应达平衡状态,则有
| 0.3×c(H2) |
| 0.12 |
(2)设平衡时转化水蒸气为xmol,
C(s)+H2O(g)
 CO(g)+H2(g)
CO(g)+H2(g)起始:1.0mol 0 0
转化:x x x
平衡:(1-x) x x
| 1-x+x+x |
| 1 |
| 0.25 |
| 1 |
固体对反应速率和化学平衡都没有影响,加入碳粉,水蒸气的转化率不变,故答案为:25%;不变;
(3)Cu2O能被CO还原生成CO2和Cu,该反应为可逆反应,反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,反应为Cu2O+CO
 2Cu+CO2,
2Cu+CO2,故答案为:Cu2O+CO
 2Cu+CO2;
2Cu+CO2;(4)通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-=4CO2,通入空气和CO2的混合气体一极为原电池的正极,发生还原反应,
电极反应式为O2+4e-+2CO2=2CO32-,故答案为:2CO-4e-+2CO32-=4CO2; O2+4e-+2CO2=2CO32-.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案(14分)水煤气是一种高效气体燃料,其主要成分是CO和H2,可用水蒸气通过炽热的炭制得:C (s) + H2O(g) CO (g) +H2 (g) △H=+131kJ?mol-1
CO (g) +H2 (g) △H=+131kJ?mol-1
⑴T温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
| 容器 编号 | c(H2O) /mol·L-1 | c(CO) /mol·L-1 | c(H2) /mol·L-1 | v正、v逆比较 |
| I | 0.06 | 0.60 | 0.10 | v正=v逆 |
| II | 0.06 | 0.50 | 0.40 | ① |
| III | 0.12 | 0.40 | 0.80 | v正<v逆 |
| IV | 0.12 | 0.30 | ② | v正=v逆 |
⑵另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和1.0 mol水蒸气 (H2O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为 ;向该容器中补充a mol 炭,水蒸气的转化率将 (填 “增大”、“减小”、“不变”)。
⑶在一定条件下用水煤气能合成甲醇:CO(g)+2H2(g)
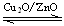 CH3OH(g) △H>0给合成甲醇反应体系中通入少量CO则平衡向 移动,减小压强则平衡向 移动,降低温度则平衡向 移动(填左,右,不)
CH3OH(g) △H>0给合成甲醇反应体系中通入少量CO则平衡向 移动,减小压强则平衡向 移动,降低温度则平衡向 移动(填左,右,不)⑷熔融盐燃料电池具有高的发电效率,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,其中一极通入CO,另一极通入空气和CO2的混合气体。根据上述信息,该燃料电池:负极反应式为 ;正极反应式为 。
(5)已知在常温常压下:
①2CH3OH (l)+3O2 (g) == 2CO2 (g)+4H2O (g) ΔH1=-1 275.6 kJ·mol-1
②2CO (g)+O2 (g) == 2CO2 (g) ΔH2=-566.0 kJ·mol-1
③H2O (g) = H2O (l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________________
(14分)水煤气是一种高效气体燃料,其主要成分是CO和H2,可用水蒸气通过炽热的炭制得:C
(s) + H2O(g) CO (g) +H2 (g) △H
=+131kJ•mol-1
CO (g) +H2 (g) △H
=+131kJ•mol-1
⑴T温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
|
容器 编号 |
c(H2O) /mol·L-1 |
c(CO) /mol·L-1 |
c(H2) /mol·L-1 |
v正、v逆比较 |
|
I |
0.06 |
0.60 |
0.10 |
v正=v逆 |
|
II |
0.06 |
0.50 |
0.40 |
① |
|
III |
0.12 |
0.40 |
0.80 |
v正<v逆 |
|
IV |
0.12 |
0.30 |
② |
v正=v逆 |
① ② 在T温度下该反应的化学平衡常数为
⑵另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和1.0 mol水蒸气 (H2O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为 ;向该容器中补充 a mol 炭,水蒸气的转化率将 (填 “增大”、“减小”、“不变”)。
⑶在一定条件下用水煤气能合成甲醇:CO(g)+2H2(g) CH3OH(g) △H>0给合成甲醇反应体系中通入少量CO则平衡向
移动,减小压强则平衡向
移动,降低温度则平衡向
移动(填左,右,不)
CH3OH(g) △H>0给合成甲醇反应体系中通入少量CO则平衡向
移动,减小压强则平衡向
移动,降低温度则平衡向
移动(填左,右,不)
⑷熔融盐燃料电池具有高的发电效率,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,其中一极通入CO,另一极通入空气和CO2的混合气体。根据上述信息,该燃料电池:负极反应式为 ;正极反应式为 。
(5)已知在常温常压下:
①2CH3OH (l)+3O2 (g) == 2CO2 (g)+4H2O (g) ΔH1=-1 275.6 kJ·mol-1
②2CO (g)+O2 (g) == 2CO2 (g) ΔH2=-566.0 kJ·mol-1
③H2O (g) = H2O (l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________________
 CO(g)+H2(g)△H=+131kJ?mol-1
CO(g)+H2(g)△H=+131kJ?mol-1(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器 编号 | c(H2O) /mol?L-1 | c(CO) /mol?L-1 | c(H2) /mol?L-1 | v正、v逆比较 |
| I | 0.06 | 0.60 | 0.10 | v正=v逆 |
| II | 0.06 | 0.50 | 0.40 | ① |
| III | 0.12 | 0.40 | 0.80 | v正<v逆 |
| IV | 0.12 | 0.30 | ② | v正=v逆 |
(3)在一定条件下用水煤气能合成甲醇:CO(g)+2H2(g)
 CH3OH(g) 据研究,给合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示)______.
CH3OH(g) 据研究,给合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示)______.(4)熔融盐燃料电池具有高的发电效率,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,其中一极通入CO,另一极通入空气和CO2的混合气体.根据上述信息,该燃料电池:负极反应式为______;正极反应式为______.
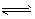 CO (g) +H2(g) △H=+131 kJ.mol-1。
CO (g) +H2(g) △H=+131 kJ.mol-1。 
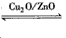 CH3OH(g),据研究,向合成甲醇的反应体系中通入少量CO,有利于维持催化剂Cu2O的量不变,原因是___ (用化学方程式表示)。
CH3OH(g),据研究,向合成甲醇的反应体系中通入少量CO,有利于维持催化剂Cu2O的量不变,原因是___ (用化学方程式表示)。