网址:http://m.1010jiajiao.com/timu3_id_292457[举报]
 CH3OH(g) △H=
CH3OH(g) △H=-90. 8 kJ/mol
(1)该热化学方程式表达的意义是_______________。
(2)在一定条件下,上述反应在一密闭容器中达到平衡。该反应平衡常数的表达式为________________;结合该表达式分析,在保证H2浓度不变的情况下,增大容器的体积,平衡________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(3)如图表示该反应在某一时间段中反应速率与反应过程的关系图(t2、t4、t5时刻改变的条件都只有一个,且各不相同)。

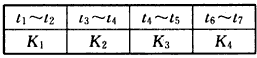
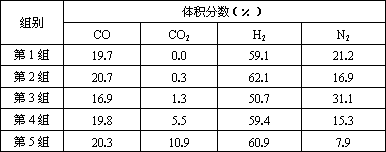
(4)原料气的加工过程中常常混有一些CO2,为了研究温度及CO2含量对该反应的影响,以CO2、CO和H2
的混合气体为原料在一定条件下进行实验。实验数据见下表

结论一:在一定条件下,反应温度越高,生成CH3OH的碳转化率_________________。
结论二:________________ 。
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)![]() CH3OH(g) ΔH<0.
CH3OH(g) ΔH<0.
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡.
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是________(填字母).
A.升高温度
B.增大压强
C.通入CO
D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡________(填字母).
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
作出此判断的理由是________
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的.实验数据见下表:
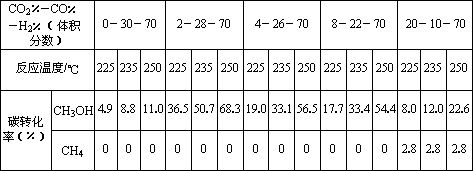
(3)由上表数据可得出多个结论.
结论一:在一定条件下,反应温度越高,碳转化率________.
结论二:________________________________
(4)为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验.
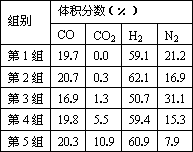
进行该验证实验时,控制不变的因素有________、________、________等.
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)![]() CH3OH(g) ΔH<0.
CH3OH(g) ΔH<0.
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡.
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是________(填字母).
A.升高温度
B.增大压强
C.通入CO
D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡________(填字母)
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
作出此判断的理由是__________________
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的.实验数据见下表:

(3)由上表数据可得出多个结论.
结论一:在一定条件下,反应温度越高,碳转化率________.
结论二:CO2含量对反应的影响为__________________
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)![]() CH3OH(g)ΔH<0.
CH3OH(g)ΔH<0.
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡.
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是________(填字母).
A.升高温度
B.增大压强
C.通入CO
D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡________(填字母).
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
作出此判断的理由是________________________
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的.实验数据见下表:
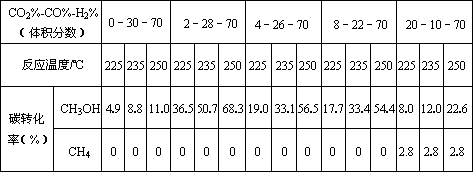
(3)由上表数据可得出多个结论.
结论一:在一定条件下,反应温度越高,碳转化率__________.
结论二:_____________________________________________
(4)为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验.
进行该验证实验时,控制不变的因素有________________、_________________、____________________________________________等.
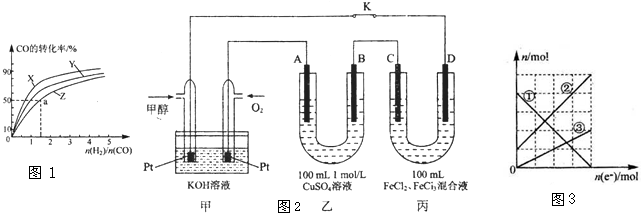
Ⅰ.工业上一般以CO和H2为原料在密闭容器中合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8KJ/mol
(1)在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.如图1是上述三 种温度下不同的H2和CO的起始组成比(起始时CO的物质 的量均为1mol)与CO平衡转化率的关系,则曲线X对应的 温度是
(2)某温度下,将1mol CO和3mol H2充入1L的密闭容器中,充分反应后,达到平衡时 c(CO)=0.1mol/L.若保持温度和体积不变,将起始物质的物质的量改为a mol CO、b mol H2,c mol CH3OH,欲使开始时该反应向逆反应方向进行,c的取值范围是
Ⅱ.图2是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A,B两极上产生的气体体积相同.
(3)甲中负极的电极反应式为
(4)乙中A极析出的气体在标准状况下的体积为
(5)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图3,则图中②线表示的是