题目内容
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:CO(g)+2H2(g) CH3OH(g) △H=
CH3OH(g) △H=
-90. 8 kJ/mol
(1)该热化学方程式表达的意义是_______________。
(2)在一定条件下,上述反应在一密闭容器中达到平衡。该反应平衡常数的表达式为________________;结合该表达式分析,在保证H2浓度不变的情况下,增大容器的体积,平衡________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(3)如图表示该反应在某一时间段中反应速率与反应过程的关系图(t2、t4、t5时刻改变的条件都只有一个,且各不相同)。
 CH3OH(g) △H=
CH3OH(g) △H=-90. 8 kJ/mol
(1)该热化学方程式表达的意义是_______________。
(2)在一定条件下,上述反应在一密闭容器中达到平衡。该反应平衡常数的表达式为________________;结合该表达式分析,在保证H2浓度不变的情况下,增大容器的体积,平衡________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(3)如图表示该反应在某一时间段中反应速率与反应过程的关系图(t2、t4、t5时刻改变的条件都只有一个,且各不相同)。

各阶段对应的平衡常数如表所示
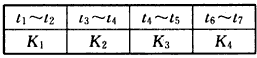
请判断K1、K2、K3、K4之间的关系为_________(用“>” “<”或“=”连接)。
(4)原料气的加工过程中常常混有一些CO2,为了研究温度及CO2含量对该反应的影响,以CO2、CO和H2
的混合气体为原料在一定条件下进行实验。实验数据见下表
(4)原料气的加工过程中常常混有一些CO2,为了研究温度及CO2含量对该反应的影响,以CO2、CO和H2
的混合气体为原料在一定条件下进行实验。实验数据见下表

由表中数据可得出多个结论。
结论一:在一定条件下,反应温度越高,生成CH3OH的碳转化率_________________。
结论二:________________ 。
结论一:在一定条件下,反应温度越高,生成CH3OH的碳转化率_________________。
结论二:________________ 。
(1)1 mol CO(g)与2 mol H2(g)完全反应生成1mol CH3OH(g) 放出90.8 kJ的热量
(2)K=c(CH3OH)/[c(CO)·c2(H2)];C
(3)K1>K2=K3=K4
(4)越高;原料气含少量CO2有利于提高生成甲醇的碳转化率,CO2含量过高生成甲醇的碳转化率又降低
(2)K=c(CH3OH)/[c(CO)·c2(H2)];C
(3)K1>K2=K3=K4
(4)越高;原料气含少量CO2有利于提高生成甲醇的碳转化率,CO2含量过高生成甲醇的碳转化率又降低

练习册系列答案
相关题目


 甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知CH3OH(l)O2(g)=CO(g)+2H2O(g) △Ha=-443.64KJ?mol-1 2CO(g)+O2(g)=2CO2(g)
甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知CH3OH(l)O2(g)=CO(g)+2H2O(g) △Ha=-443.64KJ?mol-1 2CO(g)+O2(g)=2CO2(g)