题目内容
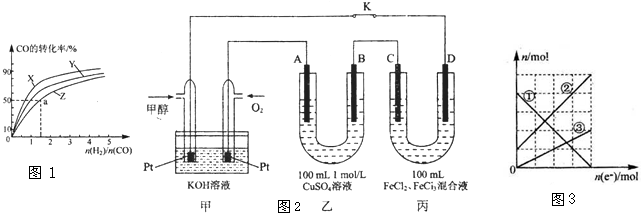
Ⅰ.工业上一般以CO和H2为原料在密闭容器中合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8KJ/mol
(1)在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.如图1是上述三 种温度下不同的H2和CO的起始组成比(起始时CO的物质 的量均为1mol)与CO平衡转化率的关系,则曲线X对应的 温度是
(2)某温度下,将1mol CO和3mol H2充入1L的密闭容器中,充分反应后,达到平衡时 c(CO)=0.1mol/L.若保持温度和体积不变,将起始物质的物质的量改为a mol CO、b mol H2,c mol CH3OH,欲使开始时该反应向逆反应方向进行,c的取值范围是
Ⅱ.图2是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A,B两极上产生的气体体积相同.
(3)甲中负极的电极反应式为
(4)乙中A极析出的气体在标准状况下的体积为
(5)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图3,则图中②线表示的是
| c(CH3OH) |
| c(CO)?c2(H2) |
(2)计算出平衡时CH3OH(g)的物质的量,c大于此值平衡向逆反应进行,按化学计量数转化到左边,得到1mol CO时c的值最大,据此计算解答;
(3)通入甲醇的一极为原电池的负极,发生氧化反应,甲醇在碱性条件下被氧化生成碳酸根离子;
(4)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气;A电极为阳极,溶液中的氢氧根离子失电子生成氧气;阳极电极反应和电子守恒计算得到;
(5)C电极为阳极,D电极为阴极,根据丙图可知溶液中有三种金属阳离子,而根据丙的成分可知溶液中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此C电极是Cu做阳极,D电极是石墨做阴极,根据转移电子的物质的量和金属阳离子的物质的量的变化确定曲线对应的离子,结合转移电子的物质的量计算.
CO(g)+2H2(g)?CH3OH (g)
起始(mol/L) 1 1.5 0
转化(mol/L) 0.5 1 0.5
平衡(mol/L) 0.5 0.5 0.5
K=
| c(CH3OH) |
| c(CO)?c2(H2) |
| 0.5 |
| 0.5×0.52 |
故答案为:X;4.00;
(2)某温度下,将1mol CO和3mol H2充入1L的密闭容器中,充分反应后,达到平衡时 c(CO)=0.1mol/L,则平衡时CH3OH的物质的量为0.9mol/L×1L=0.9mol,所以c>0.9mol平衡向逆反应进行,按化学计量数转化到左边,得到1mol CO时c的值最大,所以c最大为1mol.所以0.9<c<≤1,
故答案为:0.9<c<≤1;
(3)甲醇燃料电池是原电池反应,甲醇在负极失电子发生氧化反应,电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(4)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气,设生成气体物质的量为X,溶液中铜离子物质的量为0.1mol,电极反应为:
Cu2++2e-=Cu,
0.1mol 0.2mol
2H++2e-=H2↑,
2x x
A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:
4OH--4e-=2H2O+O2↑,
4x x
得到0.2+2x=4x,
x=0.1mol
乙中A极析出的气体是氧气物质的量为0.1mol,在标准状况下的体积为2.24L,
故答案为:2.24L;
(5)根据转移电子的物质的量和金属阳离子的物质的量的变化,可知,铜离子从无增多,铁离子物质的量减小,亚铁离子增加,①为Fe3+,②为Fe2+,③为Cu2+,
依据(2)计算得到电子转移为0.2mol,当电子转移为0.2mol时,丙中阳极电极反应Cu-2e-=Cu2+,生成Cu2+物质的量为0.1mol,图象分析每个单位为0.05mol,阴极电极反应Fe3++e-=Fe2+,溶液中有Fe3+ 0.2mol,Fe2+ 0.3mol,Cu2+为0.1mol,所以需要加入NaOH溶液1.4mol,所以NaOH溶液等体积为
| 1.4mol |
| 5mol/L |
故答案为:Fe2+;280.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案(15分)生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如下图。
(1)下列有关说法正确的是 。
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g) CH3OH(g) △H= -90.8kJ·mol-1。
CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO 、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α1 | α 2 | α3 |
a. c1=c2 b. 2Q1=Q3 c. K1=K3 d. α2+ α3< 100%
(4)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)①若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“ >”、“ < ”或“=”),理由是
。平衡时n(CH3OCH3)= mol。
②下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。

b电极是 极;a电极的反应式为 。
(15分)生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如下图。
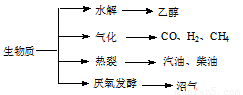
(1)下列有关说法正确的是 。
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g) CH3OH(g) △H= -90.8kJ·mol-1。
CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
容器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
1molCO 、2molH2 |
1mol CH3OH |
2molCO、4molH2 |
|
CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出Q1 kJ |
吸收Q2 kJ |
放出Q3 kJ |
|
平衡常数 |
K1 |
K2 |
K3 |
|
反应物转化率 |
α 1 |
α 2 |
α 3 |
下列说法正确的是 。
a. c1 = c2 b. 2Q1 = Q3 c. K1=K3 d. α2+ α3< 100%
(4)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
①若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“ >”、“ < ”或“=”),理由是
。平衡时n(CH3OCH3)= mol。
②下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。
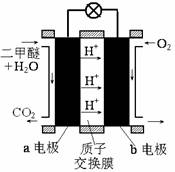
b电极是 极;a电极的反应式为 。
 生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如图.
生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如图.