摘要:28.已知可逆反应.达到平衡时. .是常数.只与温度有关.与浓度无关. (1)830时.若起始时:c(CO)=2mol/L.c()=3mol/L.平衡时C0的转化率为60%.水的转化率为 ,K值为 , (2)830时.若起始时:c(CO)=2mol/L.c()=6mol/L.则水蒸气的转化率为 , (3)830时.若起始时:c(CO)=amol/L.c()=bmol/L.的平衡浓度c()=cmol/L: ①a.b.c之间的关系式是 : ②当a=b时.a= .
网址:http://m.1010jiajiao.com/timu3_id_289845[举报]
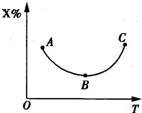 已知可逆反应:X(g)+Y(g)?E(g),现将X和Y按一定比例混合,其他条件不变时,在不同温度下,反应混合物中X体积分数的变化曲线如图所示.请分析图象并回答下列问题:
已知可逆反应:X(g)+Y(g)?E(g),现将X和Y按一定比例混合,其他条件不变时,在不同温度下,反应混合物中X体积分数的变化曲线如图所示.请分析图象并回答下列问题:(1)B点v正与v逆的大小关系是
v正=v逆
v正=v逆
,曲线BC(不包括B点和C点).v正与v正的大小关系是v正<v逆
v正<v逆
.(2)达到平衡后,升高温度,化学反应速率增大程度较小的是
v正
v正
(填“v正”或“v逆”).(3)此可逆反应的正反应是
放热反应
放热反应
(填“放热反应”或“吸热反应”).已知可逆反应:M(g)+N(g)═P(g)+Q(g);△H>0.在某温度下,反应物的起始浓度分别为:c(M)=1.0mol/L,c(N)=3.0mol/L,达到平衡时N的转化率为25%.下列说法正确的是( )
查看习题详情和答案>>
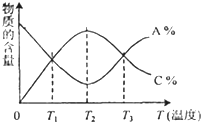 已知可逆反应aA+bB?cC中,物质的含量A%和C%随时间进行、温度的变化曲线如图所示,下列说法正确的是( )
已知可逆反应aA+bB?cC中,物质的含量A%和C%随时间进行、温度的变化曲线如图所示,下列说法正确的是( )| A、该反应在T1温度时已达到过化学平衡 | B、该反应在T3温度时才达到过化学平衡 | C、增大压强平衡一定会向正反应方向移动 | D、该可逆反应的正反应是放热反应 |
已知可逆反应X(g)+Y(g)?Z(g)(未配平).温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )
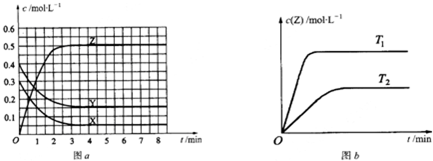

| A、发生反应时,各物质的反应速率大小关系为:v(X)=v(Y)=2v(Z) | B、图a中反应达到平衡时,Y的转化率为37.5% | C、增大压强,平衡向正反应方向移动 | D、该反应正反应的反应热△H>0 |