摘要:17.下列用核电荷数表示出的各组元素.有相似性质的是 ( ) A. 19和55 B. 6和14 C. 16和17 D. 12和24
网址:http://m.1010jiajiao.com/timu3_id_286737[举报]
 (1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.
(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.①写出元素符号:A
H
H
,CS
S
,EK
K
.②B、D的最高价氧化物对应水化物相互反应的离子方程式为:
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.③用电子式表示C与E形成E2C的过程:


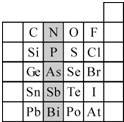
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
①阴影部分元素N在元素周期表中的位置为第
二
二
周期第ⅤA
ⅤA
族.根据元素周期律,预测:酸性强弱 H3AsO4
<
<
H3PO4.(用“>”或“<”表示)②元素S的最高正价和最低负价的代数和为
+4
+4
,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度更小
更小
.(选填“更大”、“更小”或“相同”)③Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是
Br-、SO42-、H+
Br-、SO42-、H+
.④下列说法正确的是
A、B、D
A、B、D
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱.
已知A、B、C、D四种短周期元素的原子序数依次增大,B的核电荷数是A、D核电荷数之和的
倍;A能分别与B、C、D形成电子总数相等的分子X、Y、Z.请回答下列问题:
(1)B、D两元素的名称分别是 、 .
(2)化合物B2A2的电子式为 .
(3)Y与C的最高正价氧化物的水化物刚好完全反应时,其生成物的水溶液呈 性(填“酸”“碱”或“中”),其原因是(用离子方程式表示) .
(4)在(3)所得生成物的水溶液中,存在着如下关系,用粒子浓度符号填写:
①c(H+)+ =c(OH-)+ ;
②c(H+)=c(OH-)+ .
(5)若0.2mol液态化合物B2A8C2与液态C2D4完全反应,生成气态的C2、Z和BD2,同时放出510kJ热量,试写出该反应的热化学方程式:
(6)化合物C2A4是可燃性液体,也可用作火箭燃料.C2A4-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30% 的KOH溶液,放电时生成C2、Z,则C2A4-空气燃料电池放电时,负极的电极反应式是 .
查看习题详情和答案>>
| 2 | 3 |
(1)B、D两元素的名称分别是
(2)化合物B2A2的电子式为
(3)Y与C的最高正价氧化物的水化物刚好完全反应时,其生成物的水溶液呈
(4)在(3)所得生成物的水溶液中,存在着如下关系,用粒子浓度符号填写:
①c(H+)+
②c(H+)=c(OH-)+
(5)若0.2mol液态化合物B2A8C2与液态C2D4完全反应,生成气态的C2、Z和BD2,同时放出510kJ热量,试写出该反应的热化学方程式:
(6)化合物C2A4是可燃性液体,也可用作火箭燃料.C2A4-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30% 的KOH溶液,放电时生成C2、Z,则C2A4-空气燃料电池放电时,负极的电极反应式是
A、B、C、D、E、F、G都是短周期主族元素,它们的核电荷数依次增大.元素A的原子核内仅有一个质子,A、D同主族,B、C为同周期元素且与A能形成相同电子数的化合物,C与F同主族,F的质子数为C的2倍,元素E的最外层电子数比K层电子数多1,B、C、F的质子数之和等于E、G的质子数之和.请回答下列问题:
(1)写出由上述至少两种元素组成的具有漂白作用的物质的化学式
(2)A分别与B、C、G能形成相应的最常见三种化合物,这三种化合物的沸点由高到低的顺序为
(3)由A、B、C、D四种元素组成的一种常见化合物的溶液分别与由A、C、D、E四种元素组成的一种化合物的溶液和由E、G两种元素组成的一种化合物的溶液都能反应得到同一种白色沉淀,写出上述两个反应的离子方程式
(4)D、E两种元素的原子都能形成相应的离子,则两离子半径大小关系为
查看习题详情和答案>>
(1)写出由上述至少两种元素组成的具有漂白作用的物质的化学式
SO2、Na2O2、HClO、NaClO
SO2、Na2O2、HClO、NaClO
(至少写出四种).(2)A分别与B、C、G能形成相应的最常见三种化合物,这三种化合物的沸点由高到低的顺序为
H2O>HCl>CH4
H2O>HCl>CH4
(用化学式表示).(3)由A、B、C、D四种元素组成的一种常见化合物的溶液分别与由A、C、D、E四种元素组成的一种化合物的溶液和由E、G两种元素组成的一种化合物的溶液都能反应得到同一种白色沉淀,写出上述两个反应的离子方程式
HCO3-+[Al(OH)4]-+H2O═CO32-+Al(OH)3↓
HCO3-+[Al(OH)4]-+H2O═CO32-+Al(OH)3↓
、3HCO3-+Al3+═Al(OH)3↓+3CO2↑
3HCO3-+Al3+═Al(OH)3↓+3CO2↑
.(4)D、E两种元素的原子都能形成相应的离子,则两离子半径大小关系为
r(Na+)>r(Al3+)
r(Na+)>r(Al3+)
(用离子符号表示);将D、E两种元素的单质同时投入水中,充分反应后,测得溶液中只有一种溶质,且无固体物质剩余,则所投入到水中的D的单质和E的单质的质量之比为23:27
23:27
,上述反应的化学方程式为Na+Al+4H2O═Na[Al(OH)4]+2H2↑
Na+Al+4H2O═Na[Al(OH)4]+2H2↑
;若D的单质的物质的量为x mol,则上述反应中得到另一物质的物质的量为2xmol
2xmol
.X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,Q的核电荷数是X与Z的核电荷数之和,表中E在元素周期表的各元素中电负性最大.请回答下列问题:
(1)X、Y的元素符号依次为
(2)XZ2与YZ2分子的立体结构分别是
(3)Q的元素符号是
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键
查看习题详情和答案>>
(1)X、Y的元素符号依次为
S
S
、C
C
;(2)XZ2与YZ2分子的立体结构分别是
V形
V形
和直线形
直线形
,(3)Q的元素符号是
Cr
Cr
,它属于第四
四
周期,它的价电子层电子排布式为3d54s1
3d54s1
,在形成化合物时它的最高化合价为+6
+6
;(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键
H-F…H
H-F…H
.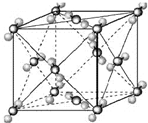 (2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
(2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.试回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)基态Ga原子的核外电子排布式为
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p1
.(2)A、B、C的第一电离能由大到小的顺序为
N>C>Si
N>C>Si
.(3)B元素的单质分子中有
2
2
个π键,与其互为等电子体的物质的化学式可能为CO(或其他合理答案)
CO(或其他合理答案)
(任写一种).(4)上述A的氧化物分子的中心原子采取
sp
sp
杂化,其晶胞中微粒间的作用力为范德华力
范德华力
.(5)EH3分子的空间构型为
三角锥形
三角锥形
,其沸点与BH3相比低
低
(填“高”或“低”),原因是NH3分子间能形成氢键,AsH3分子间不能形成氢键
NH3分子间能形成氢键,AsH3分子间不能形成氢键
.(6)向CuSO4溶液中逐滴加入BH3的水溶液,得到深蓝色的透明溶液.请写出该反应的离子方程式
Cu2++2NH3?H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
Cu2++2NH3?H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
.