网址:http://m.1010jiajiao.com/timu3_id_284802[举报]

(1)该产业链中合成氨的反应在较低温下能否自发进行?
(2)已知该产业链中某反应的平衡表达式为:K=
| C(H2)C(CO) |
| C(H2O) |
(3)已知在一定温度下,各反应的平衡常数如下:
C(s)+CO2(g)?2CO(g),K1
CO(g)+H2O(g?H2(g)+CO2(g),K2
C(s)+H2O(g)?CO(g)+H2(g),K3
则K1、K2、K3之间的关系是:
(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(5)从图中看出氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
 .已知N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式为
.已知N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式为A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(6)以上述产业链中甲醇为燃料制成燃料电池,请写出在氢氧化钾介质中该电池的负极反应式
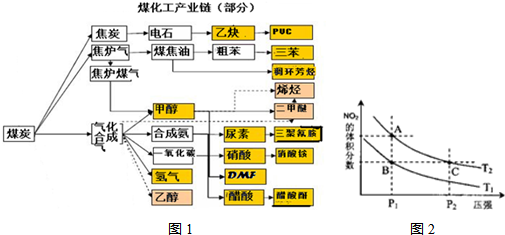
(1)该产业链中属于高中阶段常见的在低温下能自发进行的反应是:
(2)已知该产业链中某反应的平衡表达式为:
K=
| c(H2)c(CO) |
| c(H2O) |
(3)已知在一定温度下,
C(s)+CO2(g)?2CO(g)平衡常数K1;
CO(g)+H2O(g )?H2(g)+CO2(g)平衡常数K2;
C(s)+H2O(g)?CO(g)+H2(g) 平衡常数K3;
则K1、K2、K3之间的关系是:
(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(5)从图1看出氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(6)0.2mol/L的NaOH与0.4mol/L的上述产业链中一产品化肥硝酸铵溶液等体积混合后,溶液中所有分子和离子( 除水和氨分子外)等微粒从大到小的顺序是
(7)以上述产业链中甲醇为燃料制成燃料电池,请写出在氢氧化钾介质中该电池的负极反应式
(10分)在一密闭体系中发生下列反应:N2(g)+3H2(g)  2NH3(g);△H<0 。
2NH3(g);△H<0 。
回答下列问题:
(1)在一定温度下,向一容积为2L的密闭容器中通入0.3molN2和0.9molH2,2min达到平衡时,C(N2)为0.1mol/L,则H2的转化率为____________________,用H2浓度变化表示的平均
反应速率为__ ____ ,该温度下的平衡常数K= ____________。
(2)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态(1)相同,则起始时n(NH3)的取值范围为 ___________________ 。
(3)右图是某一时间段速率-时间曲线图。
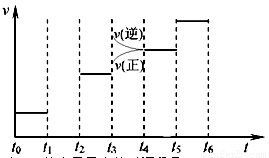
若图中t1时刻将容器体积变为原来的1/2倍,当t2时刻再次达到平衡时N2的浓度为原平衡的1.9倍,则平衡 _____
(“正移”“逆移”“不移动”)。
①请在图中画出t1→t2时间段反应速率变化情况。
②t3、t5时刻体系中所改变的某一条件分 别是:__________________________、_______________;其中表示平衡混合物中NH3的含量最高的时间段是___________.
查看习题详情和答案>>
(9分)在一定温度下,向一个容积不变的容器中加入3 mol SO2和2 mol O2及固体催化剂,发生反应:2SO2(g)+O2(g)=2SO3(g)ΔH=-196.6 kJ/mol,平衡时容器内气体压强为起始时的90%。
(1)加入3mol SO2和3mol O2发生反应,达到平衡时,SO2的转化率为_____。
(2)保持温度不变,在相同的容器中,将起始物质的物质的量改为a mol SO2、b mol O2、c mol SO3(g)(c>0),欲使平衡时SO3的体积分数为2/9,O2的体积分数为3/9,则:
①达到平衡时,(1)与(2)放出的热量________(填序号)。
| A.相等 | B.前者小于后者 | C.前者大于后者 | D.无法确定 |
(10分)在一密闭体系中发生下列反应:N2(g)+3H2(g) 2NH3(g);△H<0 。
回答下列问题:
(1)在一定温度下,向一容积为2L的密闭容器中通入0.3molN2和0.9molH2,2min达到平衡时,C(N2)为0.1mol/L,则H2的转化率为____________________,用H2浓度变化表示的平均
反应速率为__ ____ ,该温度下的平衡常数K= ____________。
(2)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态(1)相同,则起始时n(NH3)的取值范围为 ___________________ 。
(3)右图是某一时间段速率-时间曲线图。
若图中t1时刻将容器体积变为原来的1/2倍,当t2时刻再次达到平衡时N2的浓度为原平衡的1.9倍,则平衡 _____
(“正移”“逆移”“不移动”)。
①请在图中画出t1→t2时间段反应速率变化情况。
②t3、t5时刻体系中所改变的某一条件分 别是:__________________________、_______________;其中表示平衡混合物中NH3的含量最高的时间段是___________.
查看习题详情和答案>>