摘要:35.固体混合物A中含有AlCl3.Al2O3和Fe2O3.A在一定条件下可实现下图所示的变化.填写下列空白: (1)沉淀B为 .沉淀C为 . (2)溶液乙中的生成物为 . (3)写出反应①的化学方程式 . 福建省厦门第一中学2008-2009学年度第一学期期中考试
网址:http://m.1010jiajiao.com/timu3_id_284706[举报]
(2013?丰台区二模)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)固体混合物A中的成分是
(2)反应Ⅰ完成后,铁元素的存在形式为
请写出生成该离子的离子方程式
(3)x、y对应的数值范围分别是
(4)电解法获取Cu时,阴极反应式为
(5)下列关于NaClO调pH的说法正确的是
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+H+?HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+H2O?HClO+OH-,OH-消耗H+,从而达到调节pH的目的
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为
查看习题详情和答案>>

已知:Cu2O+2H+=Cu+Cu2++H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
SiO2、Cu
SiO2、Cu
.(2)反应Ⅰ完成后,铁元素的存在形式为
Fe2+
Fe2+
.(填离子符号)请写出生成该离子的离子方程式
2Fe3++Cu=Cu2++2Fe2+
2Fe3++Cu=Cu2++2Fe2+
.(3)x、y对应的数值范围分别是
3.2≤pH<4.0
3.2≤pH<4.0
、5.2≤pH<5.4
5.2≤pH<5.4
.(4)电解法获取Cu时,阴极反应式为
Cu2++2e-=Cu
Cu2++2e-=Cu
,阳极反应式为2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
.(5)下列关于NaClO调pH的说法正确的是
b
b
.a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+H+?HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+H2O?HClO+OH-,OH-消耗H+,从而达到调节pH的目的
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为
5ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4HClO
5ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4HClO
.工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: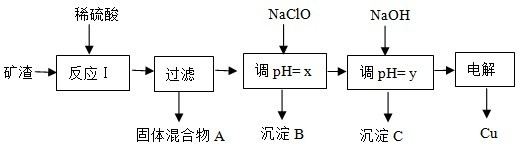
已知:Cu2O+2H+=Cu+Cu2++H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(1)固体混合物A中的成分是______.
(2)反应Ⅰ完成后,铁元素的存在形式为______.(填离子符号)
请写出生成该离子的离子方程式______.
(3)x、y对应的数值范围分别是______、______.
(4)电解法获取Cu时,阴极反应式为______,阳极反应式为______.
(5)下列关于NaClO调pH的说法正确的是______.
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+H+?HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+H2O?HClO+OH-,OH-消耗H+,从而达到调节pH的目的
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为______.
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: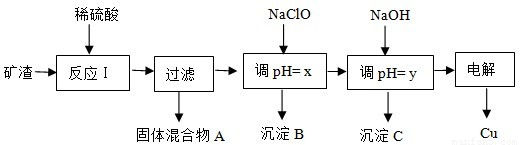
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)固体混合物A中的成分是 .
(2)反应Ⅰ完成后,铁元素的存在形式为 .(填离子符号)
请写出生成该离子的离子方程式 .
(3)x、y对应的数值范围分别是 、 .
(4)电解法获取Cu时,阴极反应式为 ,阳极反应式为 .
(5)下列关于NaClO调pH的说法正确的是 .
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+H+?HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+H2O?HClO+OH-,OH-消耗H+,从而达到调节pH的目的
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为 . 查看习题详情和答案>>

已知:Cu2O+2H+=Cu+Cu2++H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)反应Ⅰ完成后,铁元素的存在形式为 .(填离子符号)
请写出生成该离子的离子方程式 .
(3)x、y对应的数值范围分别是 、 .
(4)电解法获取Cu时,阴极反应式为 ,阳极反应式为 .
(5)下列关于NaClO调pH的说法正确的是 .
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+H+?HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+H2O?HClO+OH-,OH-消耗H+,从而达到调节pH的目的
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为 . 查看习题详情和答案>>
化学是以实验为基础的学科,化学实验又有定性实验和定量实验之分.利用已学知识对下列实验进行分析并填空:
Ⅰ.
Ⅱ.
Ⅲ.
资料:氯气难溶于饱和氯化钠溶液;实验室可利用MnO2和浓盐酸在加热的条件下制备氯气
实验:某食盐样品中混有NaBr杂质,为测定该食盐样品的纯度,设计实验过程如甲图所示:

阅读上述资料和实验过程,完成下列填空:
(1)请从乙图中选出四个装置(可重复使用),来完成制取并向溶液A中通入过量Cl2的实验,将所选装置的选项代码填入方框,并在括号中写出装置内所放的化学药品.

(2)为了证明甲图中溶液D中几乎不存在Br-,可选用的试剂为
A.碘水
B.淀粉碘化钾溶液
C.新制氯水和四氯化碳
D.食盐水
(3)依据甲图所示,在萃取操作中应选取的有机溶剂为
A.四氯化碳 B.水 C.乙醇 D.苯
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是
(5)试计算原固体混合物中氯化钠的质量分数为
查看习题详情和答案>>
Ⅰ.
| 实验目的 | 探究温度对H2O2分解反应速率的影响 探究温度对H2O2分解反应速率的影响 | ||||||||||
实验 |
 |
 |
 | ||||||||
| 实验结论 | 结论: 温度越高,反应速率越快 温度越高,反应速率越快 FeCl3在实验中的作用为: 催化剂 催化剂 | ||||||||||
| 反应方程式 | 2H2O2
2H2O2
| ||||||||||
| 实验目的 | 探究卤素单质氧化性的相对强弱 | |
| 实验 | 现象 | 离子方程式 |
| 1.将少量氯水分别加入盛有KBr和NaI溶液的试管中, 振荡后加入CCl4,振荡、静置 |
(1)溶液分层,上层几 乎无色,下层为橙色. (2) 溶液分层,上层几乎无色,下层为紫(红)色 溶液分层,上层几乎无色,下层为紫(红)色 |
(1) Cl2+2Br-=Br2+2Cl- Cl2+2Br-=Br2+2Cl- (2) Cl2+2I-=I2+2Cl- Cl2+2I-=I2+2Cl- |
| 2.将少量溴水加入盛有NaI溶液的试管中, 振荡后加入少量CCl4,振荡、静置 |
/ | (3) Br2+2I-=I2+2Br- Br2+2I-=I2+2Br- |
| 实验结论并从原子结构上解释原因 | 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱 | |
资料:氯气难溶于饱和氯化钠溶液;实验室可利用MnO2和浓盐酸在加热的条件下制备氯气
实验:某食盐样品中混有NaBr杂质,为测定该食盐样品的纯度,设计实验过程如甲图所示:

阅读上述资料和实验过程,完成下列填空:
(1)请从乙图中选出四个装置(可重复使用),来完成制取并向溶液A中通入过量Cl2的实验,将所选装置的选项代码填入方框,并在括号中写出装置内所放的化学药品.

(2)为了证明甲图中溶液D中几乎不存在Br-,可选用的试剂为
C
C
(填选项字母).A.碘水
B.淀粉碘化钾溶液
C.新制氯水和四氯化碳
D.食盐水
(3)依据甲图所示,在萃取操作中应选取的有机溶剂为
D
D
.A.四氯化碳 B.水 C.乙醇 D.苯
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是
内外气压相通,使分液漏斗内液体能够顺利流下
内外气压相通,使分液漏斗内液体能够顺利流下
.(5)试计算原固体混合物中氯化钠的质量分数为
90
90
%.
如图所示是分离混合物时常用的仪器,回答下列问题:
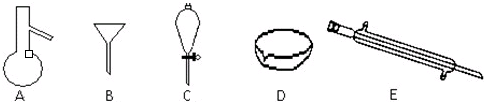
(1)写出仪器A、C、E的名称 、 、 .
(2)制取蒸馏水时,装置A中除加入少量自来水外,还需要加入少量的 ,其作用是 .
(3)下列各组物质的分离或提纯,应选用下述方法的哪一种?(填字母)
A、分液 B、过滤 C、萃取 D、蒸馏 E、结晶 F、升华
①乙酸乙酯(C4H8O2)是一种无色液体,不溶于水,密度小于1g?mL-1,沸点约为55℃.要从水与乙酸乙酯的混合物中将乙酸乙酯分离出来
②乙二醇(C2H6O2)无色液体,易溶于水和乙醇,沸点198℃.丙三醇(C3H8O3)无色液体,易溶于水和乙醇,沸点290℃.将乙二醇和丙三醇混合物相互分离的方法是
③从硝酸钾和氯化钠的混合溶液中获得硝酸钾
④氯化钠和碘的固体混合物中获得碘
(4)某化学兴趣小组拟从海带中提取碘,进行如下实验.
干海带
海带灰
浸泡液I2(CCl4)→I2
用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液.其实验可分解为如下各步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中
B.把50mL碘水和15mL四氯化碳加入分液漏斗中,并盖好玻璃塞
C.检查分液漏斗活塞和上口的玻璃塞是否漏液
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧杯接收下层溶液
F.从分液漏斗上口倒出上层溶液
G.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗上的小孔
H.静置、分层
①正确的操作顺序是
②分液后得到的下层液体是 ,颜色是
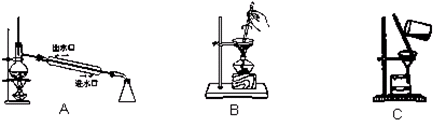
③从I2的CCl4溶液中提取单质I2并回收CCl4的可用装置 .
④萃取碘水中的碘,除可用四氯化碳,还可以用 (填字母).
A.酒精 B.水 C.汽油 D.醋酸. 查看习题详情和答案>>

(1)写出仪器A、C、E的名称
(2)制取蒸馏水时,装置A中除加入少量自来水外,还需要加入少量的
(3)下列各组物质的分离或提纯,应选用下述方法的哪一种?(填字母)
A、分液 B、过滤 C、萃取 D、蒸馏 E、结晶 F、升华
①乙酸乙酯(C4H8O2)是一种无色液体,不溶于水,密度小于1g?mL-1,沸点约为55℃.要从水与乙酸乙酯的混合物中将乙酸乙酯分离出来
②乙二醇(C2H6O2)无色液体,易溶于水和乙醇,沸点198℃.丙三醇(C3H8O3)无色液体,易溶于水和乙醇,沸点290℃.将乙二醇和丙三醇混合物相互分离的方法是
③从硝酸钾和氯化钠的混合溶液中获得硝酸钾
④氯化钠和碘的固体混合物中获得碘
(4)某化学兴趣小组拟从海带中提取碘,进行如下实验.
干海带
| 灼烧 |
| 浸泡 |
| 过滤 |
用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液.其实验可分解为如下各步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中
B.把50mL碘水和15mL四氯化碳加入分液漏斗中,并盖好玻璃塞
C.检查分液漏斗活塞和上口的玻璃塞是否漏液
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧杯接收下层溶液
F.从分液漏斗上口倒出上层溶液
G.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗上的小孔
H.静置、分层
①正确的操作顺序是
②分液后得到的下层液体是
③从I2的CCl4溶液中提取单质I2并回收CCl4的可用装置

④萃取碘水中的碘,除可用四氯化碳,还可以用
A.酒精 B.水 C.汽油 D.醋酸. 查看习题详情和答案>>