摘要:如下图所示可逆反应:mA xC(g) , ΔH = Q kJ/mol.在不同温度.压强下反应物A的转化率的变化情况.下列对于反应的热效应Q和反应方程式A.B.C的化学计量数的判断中.正确的是 A.Q > 0, m+n > x B.Q > 0, m+n < x C.Q < 0, m+n < x D.Q < 0, m+n > x
网址:http://m.1010jiajiao.com/timu3_id_284472[举报]
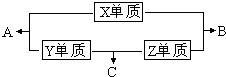 X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:已知一个B分子中含有的Z元素的原子个数比一个C分子中少一个.而M的单质在常温常压下为固体,并且M元素是形成化合物种类最多的元素.请回答下列问题:
(1)元素X在周期表中的位置
第2周期第ⅥA族
第2周期第ⅥA族
.(2)化合物C在一定条件下生成化合物A的化学方程式
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(3)常温下,将C通入元素Y的最高价氧化物的水化物的水溶液中,得到pH=5的溶液,反应后的溶液存在的平衡体系有
NH4++H2O?NH3?H2O+H+;H2O?OH-+H+;
NH4++H2O?NH3?H2O+H+;H2O?OH-+H+;
;溶液中离子浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
.(4)实验室里为制取C,常在C的浓溶液中加入生石灰.请叙述产生C的原因
氧化钙溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧化钙吸水,促使氨放出;生成的氢氧化钙电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出.
氧化钙溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧化钙吸水,促使氨放出;生成的氢氧化钙电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出.
.(5)已知Y单质和Z单质生成C的反应是可逆反应,△H<0.将等物质的量的单质Y和单质Z充入一密闭容器中,在适当催化剂和恒温条件下反应.下列说法中正确的是
ab
ab
a.达到化学平衡时,正反应与逆反应速率相等
b.反应过程中,单质Y的体积分数始终为50%
c.达到化学平衡时,Y单质和Z单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中,气体的平均相对分子质量逐渐增大
e.达到化学平衡时,再升高温度,C的体积分数增大
(6)由X、Z、M三种元素可以形成化合物M2Z6X,其蒸汽通过灼热的氧化铜,黑色的氧化铜会逐渐变红,则发生的有关化学方程式为
CH3CH2OH+CuO
CH2CHO+Cu+H2O
| 加热 |
CH3CH2OH+CuO
CH2CHO+Cu+H2O
.| 加热 |
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示反应向正向进行的程度越大
反应向正向进行的程度越大
,K值大小与温度的关系是:温度升高,K值可能增大也可能减少
可能增大也可能减少
(填一定增大、一定减小、或可能增大也可能减小).(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.CO和H2O浓度变化如下图所示,则0~4min的平均反应速率v(CO)=
0.03
0.03
mol/(L?min)t1℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.006 | 0.266 | 0.104 |
①表中3min~4min之间反应处于
平衡
平衡
状态;C1数值大于
大于
0.08mol/L (填大于、小于或等于).②反应在4min~5min之间,平衡向逆方向移动,可能的原因是
d
d
(单选),表中5min~6min之间数值发生变化,可能的原因是a
a
(单选).a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
I.工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g).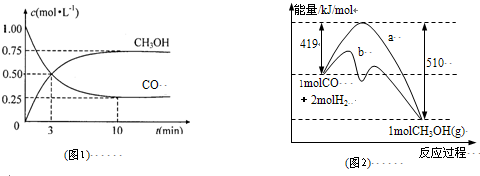
(1)图1是反应时CO和CH3OH(g)的浓度随时间变化情况.从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=
(2)图2表示该反应进行过程中能量的变化.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.该反应是
(3)该反应平衡常数K的表达式为
(4)恒容条件下,下列措施中能使
增大的有
a.升高温度; b.充入He气 c.再充入1molCO和2molH2 d.使用催化剂
II.(13分)某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置.A中所用试剂从下列固体物质中选取:a.NH4HCO3、b.NH4Cl、c.Ca(OH)2、d.NaOH.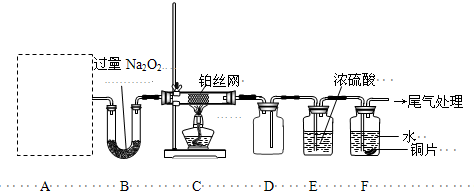
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯.部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解.
(1)实验室制取A中气体时若只用一种试剂,该试剂是
(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式:
(3)对于C中发生的可逆反应,下列说法正确的是
a.增大一种反应物的浓度可以提高另一种反应物的转化率
b.工业上进行该反应时,可采取高压的条件提高反应物转化率
c.该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
(4)请在图坐标中画出C装置中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式.
(5)待实验结束后,将B中固体混合物溶于500mL1mol?L-1 盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是
查看习题详情和答案>>

(1)图1是反应时CO和CH3OH(g)的浓度随时间变化情况.从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=
0.075mol?L-1?min-1
0.075mol?L-1?min-1
;(2)图2表示该反应进行过程中能量的变化.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.该反应是
放热
放热
(选填“吸热”或“放热”)反应,写出反应的热化学方程式CO(g)+2H2(g)═CH3OH(g)△H=-91KJ/mol
CO(g)+2H2(g)═CH3OH(g)△H=-91KJ/mol
;选择适宜的催化剂,不能
不能
(填“能”或“不能”)改变该反应的反应热;(3)该反应平衡常数K的表达式为
K=
| c(CH3OH) |
| c(CO)×c2(H2) |
K=
,温度升高,平衡常数K| c(CH3OH) |
| c(CO)×c2(H2) |
减小
减小
(填“增大”、“不变”或“减小”);(4)恒容条件下,下列措施中能使
| n(CH3OH) |
| n(CO) |
c
c
.a.升高温度; b.充入He气 c.再充入1molCO和2molH2 d.使用催化剂
II.(13分)某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置.A中所用试剂从下列固体物质中选取:a.NH4HCO3、b.NH4Cl、c.Ca(OH)2、d.NaOH.

检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯.部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解.
(1)实验室制取A中气体时若只用一种试剂,该试剂是
a
a
(填备选试剂的字母);此时A中主要的玻璃仪器有试管、酒精灯(导管)
试管、酒精灯(导管)
(填名称).(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式:
2Na2O2+2H2O=4NaOH+O2↑或2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2H2O=4NaOH+O2↑或2Na2O2+2CO2=2Na2CO3+O2
.(3)对于C中发生的可逆反应,下列说法正确的是
a
a
.a.增大一种反应物的浓度可以提高另一种反应物的转化率
b.工业上进行该反应时,可采取高压的条件提高反应物转化率

c.该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
(4)请在图坐标中画出C装置中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式.
(5)待实验结束后,将B中固体混合物溶于500mL1mol?L-1 盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是
0.25
0.25
mol,甲在标准状况下是2.8
2.8
L(忽略气体的溶解).恒温条件下,对于可逆反应A(g)+B(g)?C(g)+D(g),加入起始浓度相近的A和B,在达到平衡的过程中可能有三种情况,如下图所示.下列判断中正确的是( )
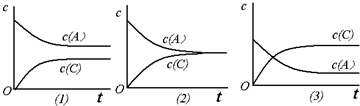

| A、(1)的K<1 | B、(2)的K≈1 | C、(3)的K>1 | D、以上三种可能全对 |
 有机化学知识在生活中应用广泛.
有机化学知识在生活中应用广泛.(1)糖类、油脂和蛋白质是动物性和植物性食物中的基本营养物质.
①下列有关说法中,正确的是
BCE
BCE
;A.棉、麻、木材、蚕丝的主要成分都是纤维素
B.油脂是产生能量最高的营养物质
C.蛋白质在人体内发生水解最终生成氨基酸
D.糖类都是有甜味的物质
E.淀粉、纤维素、蛋白质都是天然高分子化合物
②葡萄糖是最重要、最简单的单糖,除了是一种营养物质,还能用在制镜等工业上.写出葡萄糖的结构简式:
CH2OH(CHOH)4CHO
CH2OH(CHOH)4CHO
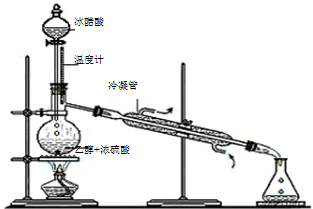
.(2)实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
①在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是
防止液体受热暴沸
防止液体受热暴沸
;②生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态.下列描述能说明该反应已达到化学平衡状态的有(填序号)
B,D,E
B,D,E
;A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的浓度不再变化.