摘要:在25°C时.用石墨电极电解2.0L2.5mol·L-1叫CuSO4溶液.如有0.20mol电子发生转移.请回答下列问题: (1)阴极发生 反应.电极反应式为 . (2)阳极发生 反应.电极反应式为 . (3)电解后得到的铜的质量是 .得到氧气的体积是 . 第 页 (4)如用等质量的两块铜片代替石墨做电极.电解后两铜片的质量相差 .电解液的pH (填“增大 .“减小 或是“不变 ). 寒假作业(三) 电能转化成化学能--电解(二) [重要知识点回顾]
网址:http://m.1010jiajiao.com/timu3_id_282968[举报]
下图中每一方框中的字母代表一种反应物或生成物。已知A、B、C、D均为元素周期表中前三周期元素的单质,也是中学化学中常见的物质。其中A、B为固体,且B是良好的半导体材料;C、D为气体。电解H的饱和溶液生成X、C和D,此反应是一个重要的工业生产反应。0.1 mol·L-1Y溶液的pH=1(图中物质间相互转化时水已略去)?

请填空:?
(1)D的化学式为? ?,Y溶液的名称是 。?
(2)B单质为? ?晶体(填晶体类型)。?
(3)A和X溶液反应的离子方程式为 。?
(4)25 ℃时,用石墨电极电解含0.4 mol H物质的水溶液,在阳极产生0.1 mol气体,测得此时溶液体积为200 mL,则此时该溶液的pH约为? ?。
查看习题详情和答案>>在25℃时,用石墨电极电解2.0 L2.5 mol/L CuSO4溶液(假设溶液的体积在电解前后不发生变化)。5min后,在一个石墨电极上有6.4 gCu生成。下列说法中正确的是
[ ]
A. 有Cu生成的一极是阴极,发生氧化反应
B. 反应中转移电子的物质的量为0.4 mol
C. 在另一极得到O2的体积(标准状况)是1.12 L
D. 此时溶液的pH为2
查看习题详情和答案>>
B. 反应中转移电子的物质的量为0.4 mol
C. 在另一极得到O2的体积(标准状况)是1.12 L
D. 此时溶液的pH为2
催化反硝化法可用于治理水中硝酸盐的污染.催化反硝化法的基本过程如下:
NO3-→NO2-→NO→N2O→N2.已知在催化反硝化法中,H2能将NO3-还原为N2,在25℃时,反应时间进行10min,测得溶液的pH由7变为12.
(1)上述反应的离子方程式为 .
(2)10分钟内的平均反应速率υ(NO3-)= mol?L-1?min-1.
(3)在常温下,测得0.1mol?L-1溶液的pH约为11,则NaNO2的水解程度(指的是已水解量与原总量的比值)为 .
(4)以下能促进NO2-水解的方法有 (用相应的编号填写,下同)
A.加入1mol?L-1 NaNO2 B.升高温度 C.加水 D.加入1mol?L-1 NaOH溶液 E.加入催化剂
(5)硝化和反硝化是两个相对的过程.硝化作用是利用硝化细菌将氨(或NH4+)氧化为硝酸的过程.下列因素中对硝化过程一般不考虑产生影响的是
A.温度 B.压强 C.PH值 D.溶解氧
(6)水体中的NH4+通过硝化后最终生成NO3-,严重污染水质,通常可以用间接电化学氧化法除去NH4+.其基本原理是用石墨作电极电解含有NH4+和Cl-等的溶液,电解过程中涉及的其中一个反应为:2NH4++3HClO→N2+3H2O+5H++3Cl-,则电解时阳极的电极反应式为 .
查看习题详情和答案>>
NO3-→NO2-→NO→N2O→N2.已知在催化反硝化法中,H2能将NO3-还原为N2,在25℃时,反应时间进行10min,测得溶液的pH由7变为12.
(1)上述反应的离子方程式为
(2)10分钟内的平均反应速率υ(NO3-)=
(3)在常温下,测得0.1mol?L-1溶液的pH约为11,则NaNO2的水解程度(指的是已水解量与原总量的比值)为
(4)以下能促进NO2-水解的方法有
A.加入1mol?L-1 NaNO2 B.升高温度 C.加水 D.加入1mol?L-1 NaOH溶液 E.加入催化剂
(5)硝化和反硝化是两个相对的过程.硝化作用是利用硝化细菌将氨(或NH4+)氧化为硝酸的过程.下列因素中对硝化过程一般不考虑产生影响的是
A.温度 B.压强 C.PH值 D.溶解氧
(6)水体中的NH4+通过硝化后最终生成NO3-,严重污染水质,通常可以用间接电化学氧化法除去NH4+.其基本原理是用石墨作电极电解含有NH4+和Cl-等的溶液,电解过程中涉及的其中一个反应为:2NH4++3HClO→N2+3H2O+5H++3Cl-,则电解时阳极的电极反应式为
 短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.
短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.请回答下列问题:
(1)C的最高价氧化物对应水化物电子式为
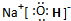
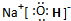
离子键、极性键
离子键、极性键
.(2)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分.将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为
2I-+ClO-+H2O=I2+Cl-+2OH-
2I-+ClO-+H2O=I2+Cl-+2OH-
(3)用石墨电极电解CD的饱和溶液,若反应后溶液的体积为200mL,测得pH为13,则阳极得到的气体的物质的量为
0.01
0.01
mol.(4)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是(填序号)
①③
①③
.①保存ED2溶液时,需向溶液中加入少量E单质
②ED2只能通过置换反应生成,ED3只能通过化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色
(5)25℃时,将pH=4.00的A元素与D元素形成化合物AD的水溶液稀释1.00×103倍,则稀释后溶液中各离子浓度必遵循的定量等式关系式是
c(OH-)+c(Cl-)=c(H+)
c(OH-)+c(Cl-)=c(H+)
.(6)将一定量的D单质通入一定浓度的苛性钾溶液,两者恰好完全反应(已知反应过程放热),生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.该苛性钾溶液中KOH的质量是
16.8
16.8
.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)25℃、101k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为△H=-57.3kJ/mol,则稀硫酸与氢氧化钾溶液反应的热化学方程式为
(2)实验测得 5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
已知反应N2+3H2?2NH3△H=x kJ?mol-1.试根据表中所列键能数据估算x的数值为
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=akJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H2=bkJ?mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=ckJ?mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:
△H=
l-1.(用含a、b、c的表达式表示)
查看习题详情和答案>>
(1)25℃、101k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为△H=-57.3kJ/mol,则稀硫酸与氢氧化钾溶液反应的热化学方程式为
KOH(aq)+
H2SO4(aq)=
K2SO4(aq)+H2O(l)△H=-57.3kJ?mol-1
| 1 |
| 2 |
| 1 |
| 2 |
KOH(aq)+
H2SO4(aq)=
K2SO4(aq)+H2O(l)△H=-57.3kJ?mol-1
.| 1 |
| 2 |
| 1 |
| 2 |
(2)实验测得 5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol
.(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 945 |
-93
-93
.(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=akJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H2=bkJ?mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=ckJ?mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:
△H=
2a+
b-
c
| 1 |
| 2 |
| 1 |
| 2 |
2a+
b-
c
kJ?moD| 1 |
| 2 |
| 1 |
| 2 |
l-1.(用含a、b、c的表达式表示)