题目内容
催化反硝化法可用于治理水中硝酸盐的污染.催化反硝化法的基本过程如下:NO3-→NO2-→NO→N2O→N2.已知在催化反硝化法中,H2能将NO3-还原为N2,在25℃时,反应时间进行10min,测得溶液的pH由7变为12.
(1)上述反应的离子方程式为
(2)10分钟内的平均反应速率υ(NO3-)=
(3)在常温下,测得0.1mol?L-1溶液的pH约为11,则NaNO2的水解程度(指的是已水解量与原总量的比值)为
(4)以下能促进NO2-水解的方法有
A.加入1mol?L-1 NaNO2 B.升高温度 C.加水 D.加入1mol?L-1 NaOH溶液 E.加入催化剂
(5)硝化和反硝化是两个相对的过程.硝化作用是利用硝化细菌将氨(或NH4+)氧化为硝酸的过程.下列因素中对硝化过程一般不考虑产生影响的是
A.温度 B.压强 C.PH值 D.溶解氧
(6)水体中的NH4+通过硝化后最终生成NO3-,严重污染水质,通常可以用间接电化学氧化法除去NH4+.其基本原理是用石墨作电极电解含有NH4+和Cl-等的溶液,电解过程中涉及的其中一个反应为:2NH4++3HClO→N2+3H2O+5H++3Cl-,则电解时阳极的电极反应式为
分析:(1)H2能将NO3-还原为N2,溶液呈碱性,说明有氢氧根离子生成,氢气被氧化生成水;
(2)根据氢氧根离子变化计算生成氢氧根离子的物质的量浓度,再根据同一反应中同一时间段内,各物质的反应速率之比等于其计量数之比计算硝酸根离子反应速率;
(3)水解程度=
×100%;
(4)稀释或升高温度都能促进盐类水解;
(5)细菌属于蛋白质,受温度、溶解氧、酸碱影响;
(6)用石墨作电极电解时溶液时,阳极上氯离子放电.
(2)根据氢氧根离子变化计算生成氢氧根离子的物质的量浓度,再根据同一反应中同一时间段内,各物质的反应速率之比等于其计量数之比计算硝酸根离子反应速率;
(3)水解程度=
| c(OH-) |
| c(NaNO2) |
(4)稀释或升高温度都能促进盐类水解;
(5)细菌属于蛋白质,受温度、溶解氧、酸碱影响;
(6)用石墨作电极电解时溶液时,阳极上氯离子放电.
解答:解:(1)H2能将NO3-还原为N2,溶液呈碱性,说明有氢氧根离子生成,氢气被氧化生成水,所以离子反应方程式为:2NO3-+5H2
N2+2OH-+4H2O,故答案为:2NO3-+5H2
N2+2OH-+4H2O;
(2)该溶液中氢氧根离子浓度由10-7 mol/L变为0.01mol/L,则v(OH-)=
=0.001mol/(L.min),同一反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(OH-)=υ(NO3-)=0.001mol/(L.min),故答案为:0.001;
(3)该溶液中c(OH-)=0.001mol/L,水解程度=
×100%=
×100%=1%,故答案为:1%;
(4)A.加入1mol?L-1 NaNO2,溶液浓度越大,盐类水解程度越小,所以抑制水解,故错误;
B.盐类水解是吸热反应,升高温度促进盐类水解,故正确;
C.加水稀释促进盐类水解,故正确;
D.加入1mol?L-1 NaOH溶液,氢氧根离子浓度增大抑制盐类水解,故错误;
E.加入催化剂不影响平衡移动,故错误;
故选BC;
(5)细菌属于蛋白质酶,酶的活性受温度、酸碱性及强氧化剂的影响,所以没有影响的是压强,故选B;
(6)用惰性电解电解,阳极上氯离子放电生成氯气,电极反应式为2Cl--2e-═Cl2↑,故答案为:2Cl--2e-═Cl2↑.
| ||
| ||
(2)该溶液中氢氧根离子浓度由10-7 mol/L变为0.01mol/L,则v(OH-)=
| (10-2-10-7)mol/L |
| 10min |
(3)该溶液中c(OH-)=0.001mol/L,水解程度=
| c(OH-) |
| c(NaNO2) |
| 0.001 |
| 0.1 |
(4)A.加入1mol?L-1 NaNO2,溶液浓度越大,盐类水解程度越小,所以抑制水解,故错误;
B.盐类水解是吸热反应,升高温度促进盐类水解,故正确;
C.加水稀释促进盐类水解,故正确;
D.加入1mol?L-1 NaOH溶液,氢氧根离子浓度增大抑制盐类水解,故错误;
E.加入催化剂不影响平衡移动,故错误;
故选BC;
(5)细菌属于蛋白质酶,酶的活性受温度、酸碱性及强氧化剂的影响,所以没有影响的是压强,故选B;
(6)用惰性电解电解,阳极上氯离子放电生成氯气,电极反应式为2Cl--2e-═Cl2↑,故答案为:2Cl--2e-═Cl2↑.
点评:本题以氮元素为载体考查电解原理、盐类水解、反应速率等知识点,根据离子放电顺序、盐类水解影响因素、反应速率公式等知识点来分析解答即可,该题考查较综合,同时考查学生对基础知识的掌握,题目难度中等.

练习册系列答案
相关题目

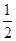 O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
 xOH-+ N2+4H2O。下列有关说法正确的是
xOH-+ N2+4H2O。下列有关说法正确的是