摘要:下表是元素周期表的一部分: 族 I A II A III A IV A V A VI A VII A 1 ① 2 ② ③ ④ ⑤ ⑥ 3 ⑦ ⑧ ⑨ ⑩ (1)表中元素的氢化物的化学式为 .此氢化物的还原性比元素的氢化物的还原性 . (2)某元素的原子结构示意图为: .该位于周期表 周期 族, 元素名称为 .其气态氢化物的结构式为 . (3)⑤与⑧可形成A3B2构型的离子化合物.用电子式表示其形成过程: . (4)写出⑦与⑨.⑦与.⑨与的最高价氧化物对应水化物反应的离子方程式: ⑦与⑨: .⑦与: . ⑨与 .
网址:http://m.1010jiajiao.com/timu3_id_280943[举报]
下表是元素周期表的一部分:
|
| I A | II A | III A | IV A | V A | VI A | VII A | ||
| 2 | ② | ③ | ④ |
| ⑤ | ⑥ |
| ||
| 3 | ⑦ | ⑧ | ⑨ |
| ⑩ | | |
(1)表中元素⑩的氢化物的化学式为___________,此氢化物的还原性比元素的氢化物的还原性______稳定性 (填强或弱)
(2)某元素的原子结构示意图为:,在周期表位于 。该
氢化物沸点比甲烷 (填高或低)。
(3)用电子式表示与⑧形成化合物形成过程: 。
(4)写出⑦与⑨、⑨与的最高价氧化物对应水化物反应的离子方程式:
⑦与⑨: 、⑨与 。
查看习题详情和答案>>
下表是元素周期表的一部分:
| I A | II A | III A | IV A | V A | VI A | VII A | ||
| 2 | ② | ③ | ④ | | ⑤ | ⑥ | | ||
| 3 | ⑦ | ⑧ | ⑨ | | ⑩ | 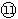 | 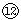 |
(1)表中元素⑩的氢化物的化学式为___________,此氢化物的还原性比元素
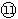 的氢化物的还原性______稳定性 (填强或弱)
的氢化物的还原性______稳定性 (填强或弱)(2)某元素的原子结构示意图为:
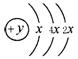 ,在周期表位于 。该
,在周期表位于 。该氢化物沸点比甲烷 (填高或低)。
(3)用电子式表示
 与⑧形成化合物形成过程: 。
与⑧形成化合物形成过程: 。(4)写出⑦与⑨、⑨与
 的最高价氧化物对应水化物反应的离子方程式:
的最高价氧化物对应水化物反应的离子方程式:⑦与⑨: 、⑨与
 。
查看习题详情和答案>>
。
查看习题详情和答案>>
下表是元素周期表的一部分:
|
|
I A |
II A |
III A |
IV A |
V A |
VI A |
VII A |
||
|
2 |
② |
③ |
④ |
|
⑤ |
⑥ |
|
||
|
3 |
⑦ |
⑧ |
⑨ |
|
⑩ |
|
|
(1)表中元素⑩的氢化物的化学式为___________,此氢化物的还原性比元素 的氢化物的还原性______稳定性 (填强或弱)
的氢化物的还原性______稳定性 (填强或弱)
(2)某元素的原子结构示意图为: ,在周期表位于
。该
,在周期表位于
。该
氢化物沸点比甲烷 (填高或低)。
(3)用电子式表示 与⑧形成化合物形成过程:
。
与⑧形成化合物形成过程:
。
(4)写出⑦与⑨、⑨与 的最高价氧化物对应水化物反应的离子方程式:
的最高价氧化物对应水化物反应的离子方程式:
⑦与⑨:
、⑨与 。
。
查看习题详情和答案>>
下表是元素周期表的一部分:
(1)表中元素⑩的氢化物的化学式为___________,此氢化物的还原性比元素 的氢化物的还原性______稳定性 (填强或弱)
的氢化物的还原性______稳定性 (填强或弱)
(2)某元素的原子结构示意图为: ,在周期表位于 。该
,在周期表位于 。该
氢化物沸点比甲烷 (填高或低)。
(3)用电子式表示 与⑧形成化合物形成过程: 。
与⑧形成化合物形成过程: 。
(4)写出⑦与⑨、⑨与 的最高价氧化物对应水化物反应的离子方程式:
的最高价氧化物对应水化物反应的离子方程式:
⑦与⑨: 、⑨与 。
。
| I A | II A | III A | IV A | V A | VI A | VII A | ||
| 2 | ② | ③ | ④ | | ⑤ | ⑥ | | ||
| 3 | ⑦ | ⑧ | ⑨ | | ⑩ |  |  |
(1)表中元素⑩的氢化物的化学式为___________,此氢化物的还原性比元素
 的氢化物的还原性______稳定性 (填强或弱)
的氢化物的还原性______稳定性 (填强或弱)(2)某元素的原子结构示意图为:
 ,在周期表位于 。该
,在周期表位于 。该氢化物沸点比甲烷 (填高或低)。
(3)用电子式表示
 与⑧形成化合物形成过程: 。
与⑧形成化合物形成过程: 。(4)写出⑦与⑨、⑨与
 的最高价氧化物对应水化物反应的离子方程式:
的最高价氧化物对应水化物反应的离子方程式:⑦与⑨: 、⑨与
 。
。下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)I的元素符号为
(2)写出基态时J元素原子的电子排布式
(3)下列对比正确的是
a.原子半径H>G>B>A; b.第一电离能E>D>C>B;
c.电负性A>H>G>K; d.最高价氧化物的水化物酸性B>A>H>G;
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是
a.L位于元素周期表中第五周期、ⅠA族,属于s区元素;
b.O位于元素周期表中第七周期、ⅧB族,属于d区元素;
c.M的外围电子排布式为6s1,属于ds区元素;
d.H所在族的外围电子排布式为ns2np2,属于p区元素;
(5)短周期中某种元素的最高价氧化物1mol与12molNaOH恰好完全反应生成正盐,该元素在元素周期表中的位置为
查看习题详情和答案>>
| A | B | C | D | E | |||||||||||||
| F | G | H | |||||||||||||||
| I | J | K | |||||||||||||||
| L | |||||||||||||||||
| M | N | ||||||||||||||||
| O | |||||||||||||||||
(1)I的元素符号为
Sc
Sc
,K的元素名称为镓
镓
.(2)写出基态时J元素原子的电子排布式
1s22s22p63s23p63d64s2
1s22s22p63s23p63d64s2
,N元素原子的简化电子排布式[Xe]4f145d106s26p5
[Xe]4f145d106s26p5
.(3)下列对比正确的是
cd
cd
.a.原子半径H>G>B>A; b.第一电离能E>D>C>B;
c.电负性A>H>G>K; d.最高价氧化物的水化物酸性B>A>H>G;
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是
bc
bc
.a.L位于元素周期表中第五周期、ⅠA族,属于s区元素;
b.O位于元素周期表中第七周期、ⅧB族,属于d区元素;
c.M的外围电子排布式为6s1,属于ds区元素;
d.H所在族的外围电子排布式为ns2np2,属于p区元素;
(5)短周期中某种元素的最高价氧化物1mol与12molNaOH恰好完全反应生成正盐,该元素在元素周期表中的位置为
三
三
周期ⅤA
ⅤA
族.