摘要:14.在容积固定的密闭容器中通入10 mol N2和30 mol H2.当反应:N2(g)+3H2(g) 2NH3(g)在一定条件下达到平衡时.H2的转化率为25%.若反应从NH3开始.在相同条件下.欲使平衡时各组分的体积分数与前者相同.则起始时NH3的物质的量及平衡时NH3的转化率为 A.15 mol,25% B.20 mol,25% C.20 mol,75% D.40 mol,75%
网址:http://m.1010jiajiao.com/timu3_id_279246[举报]
在容积固定为2L的密闭容器中,充入0.180molHI,480℃时反应:2HI(g)?H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
反应进行至10min后将反应混合物的温度降低(I2仍为气态),发现气体的颜色变浅.
(1)上述正向反应是
(2)0~2min内H2的平均反应速度为
(3)480℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数K的值为
(4)要增大反应2HI(g)?H2(g)+I2(g)的平衡常数,可采取的措施是
A.增大HI起始浓度 B.向混合气体中通入I2
C.使用高效催化剂 D.升高温度.
查看习题详情和答案>>
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(HI)/mol | 0.180 | 0.164 | 0.152 | 0.144 | 0.140 | 0.140 |
(1)上述正向反应是
吸热
吸热
反应(选填:放热、吸热).上述反应平衡时,恒容、升温,原化学平衡向正
正
反应方向移动(填“正”或“逆”),正反应速率增大
增大
(填“增大”、“减小”或“不变”).(2)0~2min内H2的平均反应速度为
0.002mol/(L?min)
0.002mol/(L?min)
.(3)480℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数K的值为
49
49
.(4)要增大反应2HI(g)?H2(g)+I2(g)的平衡常数,可采取的措施是
D
D
(选填字母).A.增大HI起始浓度 B.向混合气体中通入I2
C.使用高效催化剂 D.升高温度.
Ⅰ.在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g)  CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为 反应(填“吸热”或“放热”)。
(2)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO) =" 0.01" mol/L,c(H2O) =" 0.03" mol/L,c(CO2) =" 0.01" mol/L,c(H2) =" 0.05" mol/L,则反应开始时,H2O的消耗速率比生成速率 __ _(填“大”、“小”或“不能确定”)。
Ⅱ.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO
 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)= 。
(3)在该温度下,反应的平衡常数K= 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。 查看习题详情和答案>>
Ⅰ.在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g)  CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
请回答下列问题:
(1)该反应为 反应(填“吸热”或“放热”)。
(2)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO) =" 0.01" mol/L,c(H2O) =" 0.03" mol/L,c(CO2) =" 0.01" mol/L,c(H2) =" 0.05" mol/L,则反应开始时,H2O的消耗速率比生成速率 __ _(填“大”、“小”或“不能确定”)。
Ⅱ.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)= 。
(3)在该温度下,反应的平衡常数K= 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为 反应(填“吸热”或“放热”)。
(2)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO) =" 0.01" mol/L,c(H2O) =" 0.03" mol/L,c(CO2) =" 0.01" mol/L,c(H2) =" 0.05" mol/L,则反应开始时,H2O的消耗速率比生成速率 __ _(填“大”、“小”或“不能确定”)。
Ⅱ.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO
 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)= 。
(3)在该温度下,反应的平衡常数K= 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高。
(1)已知:1 mol N2(g)与适量H2(g)完全反应,生成NH3(g),放出92.2 kJ热量,写出反应的热化学方程式:____________________。
(2)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1______K2 (填“>” “=” 或 “<” )。
(3)在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2及固体催化剂。
10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为______,用氮气表示的反应速率为:____________。若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:__________________(任意写一条)。
(4)在上述相同条件下,若起始时加入4 mol NH3、2 mol H2及固体催化剂,反应达到平衡时NH3的体积分数比(3)中______(填“大”、“小”或“相等”)。
(5)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)。
(1)已知:1 mol N2(g)与适量H2(g)完全反应,生成NH3(g),放出92.2 kJ热量,写出反应的热化学方程式:____________________。
(2)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1______K2 (填“>” “=” 或 “<” )。
(3)在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2及固体催化剂。
10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为______,用氮气表示的反应速率为:____________。若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:__________________(任意写一条)。
(4)在上述相同条件下,若起始时加入4 mol NH3、2 mol H2及固体催化剂,反应达到平衡时NH3的体积分数比(3)中______(填“大”、“小”或“相等”)。
(5)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)。
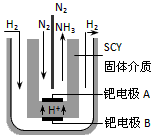
请回答:在电解法合成氨的电解池中______(填“能”或“不能”) 用水作电解质溶液的溶剂,原因是__________________。钯电极A是电解池的______极(填“阳”或“阴”),该极上的电极反应式是__________________。
查看习题详情和答案>>
(6分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)在不同温度下,反应N2(g)+O2(g)2NO(g) DH=a kJ·mol-1的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
该反应的△H 0(填“>”、“=”或“<”)。
(2)2404℃时,在容积为1.0L的密闭容器中通入2.6molN2和2.6mol O2,计算反应:
N2(g)+O2(g)2NO(g)达到平衡时N2的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
(3)科学家一直致力于研究常温常压下“人工固氮”的新方法。曾有实验报道:在常温、常压光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1)=4NH3 (g)+3O2(g) DH=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g)=4NO(g)+6H2O(1)的反应热DH= 。 (用含a的代数式表示)
查看习题详情和答案>>