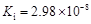网址:http://m.1010jiajiao.com/timu3_id_279171[举报]
| |||||||||||
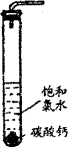
(1)写出工业上制取漂白粉的化学方程式 。?
(2)使用漂白粉时通常要加入少量的水并通入CO2,此操作方法的目的是 。?
(3)甲同学根据离子反应的实质,认为反应(2)可以证明H2CO3的酸性强于HClO,乙同学认为该反应是因为生成了难溶的物质,甲同学根据乙同学的观点思考后又写出了另一反应(并设计实验验证了确实能够发生),证明了H2CO3的酸性确实强于HClO,其反应方程式为 。?
(4)生产ClO2常用的方法是在酸性条件下还原NaClO3,例如:?
①2ClO3-+4H++2Cl-=2ClO2↑+Cl2↑+2H2O?
②2ClO3-+SO32-+2H+=2ClO2↑+SO42-+H2O?
比较两种方法,你认为 比较好。优点是 。?
查看习题详情和答案>>部分弱酸的电离平衡常数如下表:
|
弱酸 |
HCOOH |
HClO |
H2CO3 |
H2SO3 |
|
电离平衡常数 (25℃) |
|
|
|
|
(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为:________________________。
(2)下列离子方程式正确的是
A.2ClO- + H2O + CO2 → 2HClO + CO32-
B.2HCOOH + CO32- → 2HCOO- + H2O + CO2↑
C.H2SO3 + 2HCOO- → 2HCOOH + SO32-
D.Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 。
亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
(4)往亚硒酸溶液中不断通入SO2 会产生红褐色单质,写出该反应的化学方程式: 。
(5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),反应方程式如下:
H2SeO3 + H2O2 → H2SeO4+H2O,下列说法中正确的是…………………………………( )
A.H2O2既是氧化剂又是还原剂
B.H2O 既不是氧化产物又不是还原产物
C.H2SeO4既是氧化产物又是还原产物
D.氧化性:H2SeO3>H2SeO4
碲酸(H6TeO6)是一种很弱的酸, ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
HI+ H6TeO6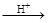 TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O
(6)若反应中生成的TeO2与Te的物质的量之比为 ,试配平上述化学方程式。
,试配平上述化学方程式。
查看习题详情和答案>>
(9分)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等类型的化合物。
⑴写出氯离子的离子结构示意图 ▲ 。
⑵写出卤素互化物溴碘原子比1∶1的共价化合物(IBr)的电子式 ▲ ,其中溴元素的化合价为 ▲ 。
⑶氟化氢气体的沸点较高,这是因为氟化氢分子之间存在 ▲ 。
⑷①HClO4、②HClO、③H2SO4的酸性由强到弱的顺序为 ▲ (填序号)。
⑸用新制的氯水、NaBr溶液、四氯化碳作为试剂,验证氯气的活泼性强于溴单质。简述实验操作过程和实验现象 ▲ 。
查看习题详情和答案>>
(1)已知在常温下,测得浓度均为0.1 mol·L-1的下列六种溶液的pH:?
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解反应存在这样一个规律:一种较强酸与一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:?
2CH3COOH + Na2CO3 =2CH3COONa + H2O+CO2↑?
若换个角度看,它同时还揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请你判断下列反应不能成立的是 (填编号)。?
A.CO2 + H2O + 2NaClO = Na2CO3 + 2HClO?
B.CO2 + H2O + NaClO = NaHCO3 + HClO?
C.CO2 + H2O + C6H5ONa![]() NaHCO3 + C6H5OH?
NaHCO3 + C6H5OH?
D.CO2 + H2O + 2C6H5ONa![]() Na2CO3 + 2C6H5OH?
Na2CO3 + 2C6H5OH?
E.Na2CO3 + C6H5OH![]() NaHCO3 + C6H5ONa?
NaHCO3 + C6H5ONa?
F.CH3COOH + NaCN![]() CH3COONa + HCN?
CH3COONa + HCN?
(2)根据前述信息判断,浓度均为0.05 mol·L-1的下列六种物质的溶液中,pH最小的
是 (填编号),其pH为 (填数值);pH最大的是 (填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4?
(3)一些复分解反应的发生还遵循其他的规律。下列转化都属于复分解反应:?
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液?
②工业上将石灰乳与苦卤(主要溶质KCl、MgCl2)混合可得氢氧化镁固体?
③侯氏制碱法中,向碳酸氢铵饱和溶液中加入饱和食盐水可获得小苏打晶体?
④蒸馏KCl和NaNO3混合溶液,首先析出NaCl晶体?
请根据上述反应,总结出复分解反应发生的另一个规律:?
。?
将KI溶液与AgCl固体混合搅拌,固体变为黄色。该反应也遵循这一规律,请写出反应的化学方程式:_____ 。
查看习题详情和答案>>