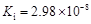题目内容
部分弱酸的电离平衡常数如下表:
|
弱酸 |
HCOOH |
HClO |
H2CO3 |
H2SO3 |
|
电离平衡常数 (25℃) |
|
|
|
|
(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为:________________________。
(2)下列离子方程式正确的是
A.2ClO- + H2O + CO2 → 2HClO + CO32-
B.2HCOOH + CO32- → 2HCOO- + H2O + CO2↑
C.H2SO3 + 2HCOO- → 2HCOOH + SO32-
D.Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 。
亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
(4)往亚硒酸溶液中不断通入SO2 会产生红褐色单质,写出该反应的化学方程式: 。
(5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),反应方程式如下:
H2SeO3 + H2O2 → H2SeO4+H2O,下列说法中正确的是…………………………………( )
A.H2O2既是氧化剂又是还原剂
B.H2O 既不是氧化产物又不是还原产物
C.H2SeO4既是氧化产物又是还原产物
D.氧化性:H2SeO3>H2SeO4
碲酸(H6TeO6)是一种很弱的酸, ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
HI+ H6TeO6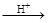 TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O
(6)若反应中生成的TeO2与Te的物质的量之比为 ,试配平上述化学方程式。
,试配平上述化学方程式。
(1)Ki值越大,酸性越强 (2分,合理给分)
(2)BD (2分)
(3)C(HCOO—)>C(Na+)>C(H+)>C(OH—) (2分)
(4)H2SeO3 + 2SO2 +H2O → Se ↓+ 2H2SO4 (2分)
(5)C (2分)
(6)8HI + 2H6TeO6 → TeO2 + Te +4I2 + 10H2O (2分)
【解析】
试题分析:(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为.Ki值越大,表示电离出氢离子的程度越大,则酸性越强。
(2)根据电离平衡常数可知A正确的是ClO- + H2O + CO2 → HClO + HCO3-,错误。B正确。C.H2SO3 + HCOO- → HCOOH + HSO3- ,错误。D.Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-,正确。
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,生成HCOONa,由于甲酸是弱酸相当于有剩余,故混和液呈酸性,HCOOH电离程度大于甲酸根的水解程度,故溶液中离子浓度由大到小的顺序为C(HCOO—)>C(Na+)>C(H+)>C(OH—)。
(4)由信息:亚硒酸(H2SeO3)有较强的氧化性。SO2 具有还原性,会产生红褐色单质应该是硒单质,则该反应的化学方程式:H2SeO3 + 2SO2 +H2O → Se ↓+ 2H2SO4。
(5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),此时过氧化氢做氧化剂,则H2SeO4既是氧化产物又是还原产物。
(6)根据化合价升降法和题目中的信息:TeO2与Te的物质的量之比为 ,配平方程式为8HI +
2H6TeO6 → TeO2 + Te +4I2 + 10H2O。
,配平方程式为8HI +
2H6TeO6 → TeO2 + Te +4I2 + 10H2O。
考点:本题考查了电离平衡常数的运用和盐类水解原理判断离子浓度的大小关系以及氧化还原方程式的配平技巧。

(2011?奉贤区二模)25时,部分弱酸的电离平衡常数如下表:
|
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A、2CN-+H2O+CO2→2HCN+CO32- |
| B、2HCOOH+CO32-→2HCOO-+H2O+CO2↑ |
| C、中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 |
| D、等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者 |
25℃时,弱酸的电离平衡常数如表,下列说法正确的是
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ki | 1.8×10-5 | 4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
B.amol/L HCN与bmol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b
C.往冰醋酸中逐滴加水,溶液导电能力先增大,后减小
D.NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO-3)+c(CO32-)
.25℃时,弱酸的电离平衡常数如右表,下列说法正确的是( )
|
弱酸 |
CH3COOH |
HCN |
H2CO3 |
|
K |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
A.等物质的量浓度溶液pH关系: pH(NaCN)> pH(Na2CO3)> pH(CH3COONa)
B.amol/L HCN与bmol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b
C.往冰醋酸中逐滴加水,溶液导电能力先增大,后减小
D.NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO-3)+c(CO32-)