摘要:4.(1)设制得氢气的质量为x. Fe + 2HCl == FeCl2 + H2↑ 56 2 = x=0.2g
网址:http://m.1010jiajiao.com/timu3_id_27327[举报]
工业上用电解水的方法制取氢气。电解4.5 t水,能制得氢气多少吨?同时得到氧气多少吨?下面是一位同学的解题过程,请同学们探究、评议。
解:设制得氢气的质量为x,氧气的质量为y。


答:电解4.5 t水,可制得氢气0.45 t,氧气7.2 t。
(1)请你指出其中的错误_____________________。
(2)请写出正确的解法。
查看习题详情和答案>>
| |||||||||||||||||||||
已知实验室制取氢气时,通常采用金属锌和稀盐酸反应,生成氯化锌和氢气.若此反应制取氢气,3、25g锌可制得氢气的质量是多少?
下面是小明同学的解题过程,请评价一下小明同学的做法是否正确,若有错误,请提出并加以改正(在原题上改)
解:设可制得氢气的质量为xg
Zn+HCl=ZnCl+H2↑
65----------1
3.25g-------x
则
=
x=
=0.05g.
查看习题详情和答案>>
下面是小明同学的解题过程,请评价一下小明同学的做法是否正确,若有错误,请提出并加以改正(在原题上改)
解:设可制得氢气的质量为xg
Zn+HCl=ZnCl+H2↑
65----------1
3.25g-------x
则
| 65 |
| 1 |
| 3.25g |
| x |
x=
| 1×3.25g |
| 65 |
下面是某同学在学习化学方程式的计算时做的一道题目,请你帮他指出错误.
题目:某同学用32.5g锌和足量稀盐酸反应制取H2,可制得H2的质量是多少?
解:设可制得H2的质量为xg.
Zn+HCl═ZnCl+H2
65 2
32.5 xg
=
x=1056.25g
答:可制得H2的质量为1056.25g.
指出错误(不受空的限制)并加以改正:
(1)
(2)
(3)
(4)
(5)
查看习题详情和答案>>
题目:某同学用32.5g锌和足量稀盐酸反应制取H2,可制得H2的质量是多少?
解:设可制得H2的质量为xg.
Zn+HCl═ZnCl+H2
65 2
32.5 xg
| 65 |
| 2 |
| xg |
| 32.5 |
x=1056.25g
答:可制得H2的质量为1056.25g.
指出错误(不受空的限制)并加以改正:
(1)
x后面有g
x后面有g
;改正设可制得H2的质量为x
设可制得H2的质量为x
.(2)
化学式ZnCl不正确,没有配平,氢气后面无↑
化学式ZnCl不正确,没有配平,氢气后面无↑
;改正Zn+2HCl═ZnCl2+H2↑
Zn+2HCl═ZnCl2+H2↑
.(3)
锌的质量后面没有单位
锌的质量后面没有单位
;改正32.5g
32.5g
.(4)
比例式不正确
比例式不正确
;改正65:2=32.5g:x
65:2=32.5g:x
.(5)
计算结果不正确
计算结果不正确
;改正x=1g
x=1g
.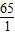 =
=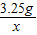
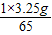 =0.05g.
=0.05g.