题目内容
已知实验室制取氢气时,通常采用金属锌和稀盐酸反应,生成氯化锌和氢气.若此反应制取氢气,3、25g锌可制得氢气的质量是多少?下面是小明同学的解题过程,请评价一下小明同学的做法是否正确,若有错误,请提出并加以改正(在原题上改)
解:设可制得氢气的质量为xg
Zn+HCl=ZnCl+H2↑
65----------1
3.25g-------x
则
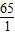 =
=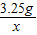
x=
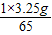 =0.05g.
=0.05g.
【答案】分析:根据利用化学方程式进行计算的步骤和方法,首先看步骤是否正确,再看解答过程中数量关系是否正确,计算数据有没有错误等.
解答:解:有四处错误:
(1)设未知数时有错误,质量x后面不应该带单位;
(2)氯化锌的化学式为“ZnCl2”,
化学方程式为:Zn+2HCl=ZnCl2+H2↑;
(3)H2的相对分子质量算错了,H2的相对分子质量为2,故比例式中的“l”应改为2;
解得x=0.1g;
(4)没有作答.
故改正为:解:设可制得氢气的质量为x,
Zn+HCl=ZnCl+H2↑
65 2
3.25g x
则 ,
,
解之得:x=0.1g.
答:可制得氢气的质量为0.1g.
点评:本题主要考查学生运用化学方程式进行计算的能力;学生最容易出错的地方就是这几项,在计算时要多加注意.
解答:解:有四处错误:
(1)设未知数时有错误,质量x后面不应该带单位;
(2)氯化锌的化学式为“ZnCl2”,
化学方程式为:Zn+2HCl=ZnCl2+H2↑;
(3)H2的相对分子质量算错了,H2的相对分子质量为2,故比例式中的“l”应改为2;
解得x=0.1g;
(4)没有作答.
故改正为:解:设可制得氢气的质量为x,
Zn+HCl=ZnCl+H2↑
65 2
3.25g x
则
 ,
,解之得:x=0.1g.
答:可制得氢气的质量为0.1g.
点评:本题主要考查学生运用化学方程式进行计算的能力;学生最容易出错的地方就是这几项,在计算时要多加注意.

练习册系列答案
相关题目
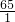 =
=
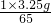 =0.05g.
=0.05g.