网址:http://m.1010jiajiao.com/timu3_id_269749[举报]
(1)方法如下:用两块铜片做阴极和阳极,以硫酸铜溶液为电解质进行电解。两极反应式为:
阴极:________________,阳极:_______________;若电流强度为I(A),时间为t(s),在阴极上铜片的质量增加m(g),铜的摩尔质量为63.5g·mol-1,已知一个1价离子所带电量(即1个电子的电荷)是1.60×10-19C,则可求得阿佛加德罗常数为:(不用化简) NA=_______________
实验步骤:连好线路。取两块纯的紫铜片(3×5cm2)当作阴、阳极。在烧杯中加入CuSO4溶液(每1L溶液含125g硫酸铜和2.5mL浓H2SO4)。阴极和阳极的2/3浸没在CuSO4溶液中,电极之间的距离约为
1.5cm,控制直流电压为10V,电阻为90~100Ω。接通电路,再调节电阻使电流约为100mA。调好电流强度后,断开电路,取下电极,将两块铜片冲洗,擦干后,用“零”号砂纸擦去表面氧化物,然后用去离子水洗净,并在一块铜片上滴几滴酒精,晾干后,在分析天平上称出其质量为13.4400g,这块铜片作为阴极。另一块铜片作阳极。重新装好电极后,接通线路,同时开动秒表,并准确记录电流强度,在电解过程中,随时调节电阻维持电流为100mA。通电1h,断开电路,取下阴、阳极。先用去离子水漂洗,再在上面滴几滴酒精,晾干后在天平上称出阴极质量为13.5590g。
(2)根据以上所测数据、计算阿佛加德罗常数为:_______________。(保留三位有效数字)
回答以下问题:
(3)电解完成后,取下电极,用去离子水漂洗的目的是:_______________,如果不漂洗,最后的结果将偏_______(高、低、无影响);
(4)电极漂洗后在上面滴几滴酒精的目的是:_______________;
(5)电解过程中,为什么要维持电流恒定?_______________;
(6)电解后水洗,若未完全晾干就称量,结果将偏___________(高、低、无影响)。

NaCl晶体结构示意图
图1-1-1
(1)将固体NaCl细粒干燥后,准确称取m g NaCl固体并转移到定容仪器A中;
(2)用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积V cm3。
请回答下列问题:
①步骤(1)中A仪器最好使用__________ (填序号)。
A.量筒 B.烧杯 C.容量瓶 D.试管
②步骤(2)中用酸式滴定管还是用碱式滴定管__________,理由是____________________。
③能否用水代替苯__________,理由是___________________________________________。
④已知NaCl晶体中,靠得最近的Na+与Cl-间的平均距离为a cm(如图1-1-1),用上述测定方法测得的阿伏加德罗常数NA的表达式为_________________________________________。
(3)另一种方法是电解法,方法是:用铂电极电解CuCl2溶液时,当电流为I,通电时间为t(单位:分钟)时,阴极增加的质量为m,在阳极收集到气体体积(标准状况)为V。又知1个电子的电荷量为Q,铜的摩尔质量为M,则计算阿伏加德罗常数NA的算式为( )
A.It/QV B.32It/mQ C.672It/QV D.30MIt/mQ
(4)由实验得知,用电解法将电解液中的金属离子还原为金属单质时,电极所通过的电量Q正比于金属的物质的量n和金属离子的化合价a的乘积,其比例系数F是一恒量,称为法拉第常数。它与金属的种类无关。
用电镀法在半径为R的铜球表面均匀镀上很薄的银层,在电解槽中铜球作__________极,另一电极材料是__________。若电流为I,通电时间为t,银的相对原子质量为A,金属银的密度为ρ,求镀层的厚度d(用本题中的符号表示)。
查看习题详情和答案>>(1)l mol B2A2分子中含σ键的数目是 。
(2)BC 2在高温高压下所形成的晶体其晶胞(晶体中最基本的重复单元)如图所示。则该晶体的类型属于 晶体(选填“分子”、“原子”、“离子”或“金属”);该晶体中B原子轨道的杂化类型为 。

(3)“生物金属”M内部原子的堆积方式与铜相同,都是面心立方堆积方式,如图。若该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,M原子的摩尔质量为Mr g/mol,则该晶胞的“边长”为 cm。

(4)“生物金属”W元素应用广泛,如人体内W元素的含量偏低,则会影响O2在体内的正常运输。已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图所示。

①W元素基态原子价电子排布式为 。
②CN—与 (一种单质分子)互为等电子体。
(5)光谱证实单质D与强碱溶液反应有[D(OH)4]—生成,则[D(OH)4]—中存在 。
a.极性键 b.配位键 c.σ键 d.π键
铜、铁、钒都是日常生活中常见的金属,具有广泛用途。请回答:
(1)在元素周期表中,铜元素位于____区,其基态原子的电子排布式为???????? 。
(2)Cu2O的熔点比Cu2S高,原因为??????????????????????? 。
(3)Fe(CO)5是一种常见的配合物,可代替四乙基铅作为汽油的抗爆震剂。
①写出CO的一种常见等电子体分子的结构式____;两者相比较沸点高的为?????? (填分子式)。
②Fe(CO)5在一定条件下发生反应:Fe(CO)5(s)=Fe(s)+5CO(g),已知:反应过程中,断裂的化学键只有配位键,由此判断该反应所形成的化学键类型为???????? 。
(4)已知AlCl3·NH3和AlCl4—中均有配位键。AlCl3·NH3中,提供空轨道的原于是____;在AlCl4中Al原子的杂化轨道类型为??????????? 。
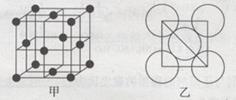
(5)金属铝的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示。则晶体铝中原子的堆积方式为____。已知:铝原子半径为d cm,摩尔质量为M g·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=??????????? 。
查看习题详情和答案>>
(1)在元素周期表中,铜元素位于____区,其基态原子的电子排布式为 。
(2)Cu2O的熔点比Cu2S高,原因为 。
(3)Fe(CO)5是一种常见的配合物,可代替四乙基铅作为汽油的抗爆震剂。
①写出CO的一种常见等电子体分子的结构式____;两者相比较沸点高的为 (填分子式)。
②Fe(CO)5在一定条件下发生反应:Fe(CO)5(s)=Fe(s)+5CO(g),已知:反应过程中,断裂的化学键只有配位键,由此判断该反应所形成的化学键类型为 。
(4)已知AlCl3·NH3和AlCl4—中均有配位键。AlCl3·NH3中,提供空轨道的原于是____;在AlCl4中Al原子的杂化轨道类型为 。
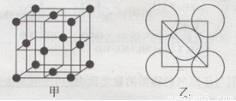
(5)金属铝的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示。则晶体铝中原子的堆积方式为____。已知:铝原子半径为d cm,摩尔质量为M g·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ= 。