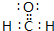题目内容
随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:
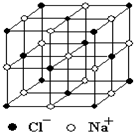
NaCl晶体结构示意图
图1-1-1
(1)将固体NaCl细粒干燥后,准确称取m g NaCl固体并转移到定容仪器A中;
(2)用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积V cm3。
请回答下列问题:
①步骤(1)中A仪器最好使用__________ (填序号)。
A.量筒 B.烧杯 C.容量瓶 D.试管
②步骤(2)中用酸式滴定管还是用碱式滴定管__________,理由是____________________。
③能否用水代替苯__________,理由是___________________________________________。
④已知NaCl晶体中,靠得最近的Na+与Cl-间的平均距离为a cm(如图1-1-1),用上述测定方法测得的阿伏加德罗常数NA的表达式为_________________________________________。
(3)另一种方法是电解法,方法是:用铂电极电解CuCl2溶液时,当电流为I,通电时间为t(单位:分钟)时,阴极增加的质量为m,在阳极收集到气体体积(标准状况)为V。又知1个电子的电荷量为Q,铜的摩尔质量为M,则计算阿伏加德罗常数NA的算式为( )
A.It/QV B.32It/mQ C.672It/QV D.30MIt/mQ
(4)由实验得知,用电解法将电解液中的金属离子还原为金属单质时,电极所通过的电量Q正比于金属的物质的量n和金属离子的化合价a的乘积,其比例系数F是一恒量,称为法拉第常数。它与金属的种类无关。
用电镀法在半径为R的铜球表面均匀镀上很薄的银层,在电解槽中铜球作__________极,另一电极材料是__________。若电流为I,通电时间为t,银的相对原子质量为A,金属银的密度为ρ,求镀层的厚度d(用本题中的符号表示)。
解析:本题主要考查对阿伏加德罗常数含义的理解和对新信息处理、理解、转化的能力,观察能力和实验分析能力。
m g NaCl固体中含NaCl粒子数为![]() NA,图示的NaCl结构含NaCl粒子数为8×
NA,图示的NaCl结构含NaCl粒子数为8×![]() +6×
+6×![]() =4,体积为8a3,故每个NaCl粒子体积为2a3,因此NaCl粒子数还可表示为
=4,体积为8a3,故每个NaCl粒子体积为2a3,因此NaCl粒子数还可表示为![]() ,即
,即![]() NA=
NA=![]() ,NA=
,NA=![]() 。
。
在(3)中Cu2++2e-====Cu,故Cu2+得电子数目为![]() ×2×NA,转移电子数为
×2×NA,转移电子数为![]() ,故有
,故有![]() ×2×NA=
×2×NA=![]() ,NA=
,NA=![]() ;有2Cl--2e-====Cl2↑知Cl-失电子数为
;有2Cl--2e-====Cl2↑知Cl-失电子数为![]() ×2×NA,于是有
×2×NA,于是有![]() ×2×NA=
×2×NA=![]() ,NA=
,NA=![]() ,故选C、D。
,故选C、D。
(4)铜球是阴极,阳极材料是Ag。
由电解定律:It=Fan,a=1,n(Ag)=![]()
所以It=F![]() ,解得d=
,解得d=![]()
答案:(2)①C ②酸式滴定管 碱式滴定管的橡胶因溶于苯而变形
③不能 NaCl溶于水,不能测出NaCl固体的体积
④NA=![]()
(3)CD (4)阴 银 d=![]()

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A、玻璃 | B、水泥 | C、生物陶瓷 | D、陶瓷 |
 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定的精确度也越来越高.现有一种简单可行的测定方法,其具体操作步骤如下:
随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定的精确度也越来越高.现有一种简单可行的测定方法,其具体操作步骤如下: