题目内容
已知A、B、C、D、M、W六种元素的原子序数依次递增,都位于前四周期。其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,且S轨道电子数是P轨道电子数的两倍;C原子L层上有2对成对电子。M和W均有“生物金属”之称,M4+离子和氩原子的核外电子排布相同;W处于周期表中第8列。请回答下列问题:
(1)l mol B2A2分子中含σ键的数目是 。
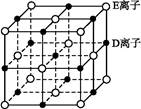
(2)BC 2在高温高压下所形成的晶体其晶胞(晶体中最基本的重复单元)如图所示。则该晶体的类型属于 晶体(选填“分子”、“原子”、“离子”或“金属”);该晶体中B原子轨道的杂化类型为 。

(3)“生物金属”M内部原子的堆积方式与铜相同,都是面心立方堆积方式,如图。若该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,M原子的摩尔质量为Mr g/mol,则该晶胞的“边长”为 cm。

(4)“生物金属”W元素应用广泛,如人体内W元素的含量偏低,则会影响O2在体内的正常运输。已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图所示。

①W元素基态原子价电子排布式为 。
②CN—与 (一种单质分子)互为等电子体。
(5)光谱证实单质D与强碱溶液反应有[D(OH)4]—生成,则[D(OH)4]—中存在 。
a.极性键 b.配位键 c.σ键 d.π键
(1)l mol B2A2分子中含σ键的数目是 。
(2)BC 2在高温高压下所形成的晶体其晶胞(晶体中最基本的重复单元)如图所示。则该晶体的类型属于 晶体(选填“分子”、“原子”、“离子”或“金属”);该晶体中B原子轨道的杂化类型为 。

(3)“生物金属”M内部原子的堆积方式与铜相同,都是面心立方堆积方式,如图。若该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,M原子的摩尔质量为Mr g/mol,则该晶胞的“边长”为 cm。

(4)“生物金属”W元素应用广泛,如人体内W元素的含量偏低,则会影响O2在体内的正常运输。已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图所示。

①W元素基态原子价电子排布式为 。
②CN—与 (一种单质分子)互为等电子体。
(5)光谱证实单质D与强碱溶液反应有[D(OH)4]—生成,则[D(OH)4]—中存在 。
a.极性键 b.配位键 c.σ键 d.π键
(1)3 NA(或1.806×1024)(2)原子 sp3杂化(3)
(4)①3d 64s2 ②N2(5)abc

(4)①3d 64s2 ②N2(5)abc
试题分析:A、B、C、D、M、W六种元素的原子序数依次递增,都位于前四周期,B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍,则B原子核外有6个电子,则B为碳元素;C原子L层上有2对成对电子,则C原子电子排布式为1s22s22p4,所以C为氧元素;原子序数A<B,B为碳元素,A原子的最外层电子数等于其周期序数,则A为氢元素;D原子的最外层电子数等于其周期序数,D原子的电子层数是A的3倍,D为铝元素,M4+离子和氩原子的核外电子排布相同,M为钛元素,W处于周期表中第8列,W为铁元素;综上所述,A为氢元素,B为碳元素,C为氧元素,D为铝元素, M为钛元素,W为铁元素。(1)B2A2分子为C2H2,结构式为H- C≡ C-H,一个乙炔共有 2个单键和一个三键 ,单键都是σ键, 而三键中只有1个σ键,另外2个是π键, 因此一个乙炔分子有3个σ键,1 mol乙炔含3 mol σ键 数目为3NA;(2)BD2是CO2,由晶体结构图可知,CO2在高温高压下形成空间网状结构,大球为碳原子,小球为氧原子,每个碳原子周围有4个氧原子,每个氧原子周围有2个碳原子,晶体中不存在CO2分子,故在高温高压下所形成的晶体为原子晶体,该晶体中C原子轨道的杂化数为4,碳原子采取sp3杂化;(3)该晶胞中钛原子个数=8×1/8+6×1/2=4,每个晶胞的质量为4Mr/NA,晶胞的密度为ρ g/cm3,则晶胞的体积为4Mr/NAρ,晶胞的边长为
 ;(4)①W为铁元素基态原子价电子排布式为3d 64s2,②一个CN—含有14个电子,与其互为等电子体的一种单质分子为等电子体N2;(5)D为铝元素,光谱证实单质D与强碱溶液反应有[Al(OH)4]-生成,[Al(OH)4]-中氧原子与氢原子之间为共价键,是单键,属于δ键,铝离子与氢氧根离子之间形成配位键,配位键也属于共价键。所以,[Al(OH)4]-中存在共价键、配位键、δ键;选:abc.
;(4)①W为铁元素基态原子价电子排布式为3d 64s2,②一个CN—含有14个电子,与其互为等电子体的一种单质分子为等电子体N2;(5)D为铝元素,光谱证实单质D与强碱溶液反应有[Al(OH)4]-生成,[Al(OH)4]-中氧原子与氢原子之间为共价键,是单键,属于δ键,铝离子与氢氧根离子之间形成配位键,配位键也属于共价键。所以,[Al(OH)4]-中存在共价键、配位键、δ键;选:abc.
练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目




 、
、 两种可能,经证实
两种可能,经证实 不溶于
不溶于 等非极性溶剂。”据此可确定
等非极性溶剂。”据此可确定 中化学键类型为________。
中化学键类型为________。 采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,
采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,
 则Pt原子的半径为_________pm(Pt的相对原子质量195.1)
则Pt原子的半径为_________pm(Pt的相对原子质量195.1) 和
和 ,它们都有很强的氧化性,
,它们都有很强的氧化性,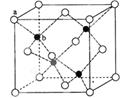
 键的个数为 。
键的个数为 。 g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm. (用
g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm. (用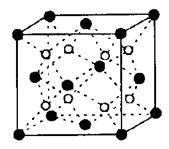
 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
 g·cm-3NA表示阿伏加德罗常数,则NaCl晶胞体积为 cm3
g·cm-3NA表示阿伏加德罗常数,则NaCl晶胞体积为 cm3