摘要:7. c ① ----------------2分 (2) a ⑤ -----------------------2分 (3) d ⑤ -----------------------2分 (4) e ③ -----------------------2分
网址:http://m.1010jiajiao.com/timu3_id_269440[举报]
A+、B+、C-、D、E五种微粒(分子或离子),每个微粒均含有10个电子.已知:①A++C-
D+E↑ ②B++C-→2D
请回答以下问题:
(1)C-离子含有的化学键为
(2)具有相同空间构型的微粒是
(3)分别写出A+和D反应,B+和E反应的离子方程式.
A++D:
查看习题详情和答案>>
| 加热 |
请回答以下问题:
(1)C-离子含有的化学键为
共价键
共价键
.(2)具有相同空间构型的微粒是
NH3
NH3
和H3O+
H3O+
.(3)分别写出A+和D反应,B+和E反应的离子方程式.
A++D:
NH4++H2O≒NH3?H2O+H+
NH4++H2O≒NH3?H2O+H+
B++E:NH3+H3O+=NH4++H2O
NH3+H3O+=NH4++H2O
.A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)

试回答:
(1)若X是强氧化性单质,则A 不可能是
a.S; b.N2;c.Na; d.Mg; e.Al
(2)若 A、B、C为烃的含氧衍生物,X为非金属单质,A与C反应生成D,D的相对分子质量为88,则C的官能团为
(3)若A、B、C为含有金属元素的无机化合物,X为强电解质,A 溶液与C溶液反应可生成B,则B的化学式可能为
(4)若 X 是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则A的电子式为
 ;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)
;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)
查看习题详情和答案>>

试回答:
(1)若X是强氧化性单质,则A 不可能是
de
de
.a.S; b.N2;c.Na; d.Mg; e.Al
(2)若 A、B、C为烃的含氧衍生物,X为非金属单质,A与C反应生成D,D的相对分子质量为88,则C的官能团为
羧基
羧基
,反应①的化学方程式为2CH3CH2OH+O2
2CH3CHO+2H2O
| 催化剂 |
| △ |
2CH3CH2OH+O2
2CH3CHO+2H2O
.| 催化剂 |
| △ |
(3)若A、B、C为含有金属元素的无机化合物,X为强电解质,A 溶液与C溶液反应可生成B,则B的化学式可能为
Al(OH)3
Al(OH)3
,X的化学式可能为 (写出不同类物质)NaOH(或KOH)
NaOH(或KOH)
或HCl
HCl
,反应①的离子方程式为Al3++3OH-=Al(OH)3↓
Al3++3OH-=Al(OH)3↓
或AlO2-+H++H2O=Al(OH)3↓
AlO2-+H++H2O=Al(OH)3↓
.(4)若 X 是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则A的电子式为


2Fe2++Fe=3Fe3+
2Fe2++Fe=3Fe3+
,检验此C溶液中金属元素价态的操作方法是用试管取少量C溶液,滴加KSCN溶液,无颜色变化,再滴加氯水(或硝酸),溶液呈红色,证明原溶液中有Fe2+存在
用试管取少量C溶液,滴加KSCN溶液,无颜色变化,再滴加氯水(或硝酸),溶液呈红色,证明原溶液中有Fe2+存在
.A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同主族元素.A、F两元素的原子核中质子数之和比C、D两元素的原子核中质子数之和少2.F元素的最外层电子数是其次外层电子数的
.又知B元素的最外层电子数是内层电子数的2倍.E元素的最外层电子数等于其电子层数.请回答:
(1)写出元素A和B形成的直线型非极性分子的电子式:
 .
.
(2)已知:泡沫灭火器的工作原理是含有A、B、C、D四种元素形成的化合物X和含有C、E、F三种元素形成的Y的水溶液间的反应,写出该反应的离子方程式:
(3)工业上制备单质E,是通过电解C和E形成的化合物;写出阴极上的电极反应式:
(4)1mol由E、F两种元素组成的化合物跟由A、C、D三种元素组成的化合物的溶液恰好完全反应,则消耗后者化合物的物质的量为
(5)含有溶质为DAB2C4的水溶液显酸性的原因是
(6)若G是周期表中第四周期第Ⅷ族的金属元素,其最高价氧化物与单质E反应的化学方程式是
查看习题详情和答案>>
| 3 |
| 4 |
(1)写出元素A和B形成的直线型非极性分子的电子式:


(2)已知:泡沫灭火器的工作原理是含有A、B、C、D四种元素形成的化合物X和含有C、E、F三种元素形成的Y的水溶液间的反应,写出该反应的离子方程式:
3HCO3-+Al3+═3CO2↑+Al(OH)3↓
3HCO3-+Al3+═3CO2↑+Al(OH)3↓
.(3)工业上制备单质E,是通过电解C和E形成的化合物;写出阴极上的电极反应式:
Al3++3e-═Al
Al3++3e-═Al
.(4)1mol由E、F两种元素组成的化合物跟由A、C、D三种元素组成的化合物的溶液恰好完全反应,则消耗后者化合物的物质的量为
8
8
mol.(5)含有溶质为DAB2C4的水溶液显酸性的原因是
HC2O4-的电离大于水解
HC2O4-的电离大于水解
.(6)若G是周期表中第四周期第Ⅷ族的金属元素,其最高价氧化物与单质E反应的化学方程式是
2Al+Fe2O3
Al2O3+2Fe
| ||
2Al+Fe2O3
Al2O3+2Fe
.
| ||
a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg5种金属中的一种.已知:(1)a、c均能与稀硫酸反应放出气体;(2)b与d的硝酸盐反应,置换出单质d;(3)c与强碱反应放出气体;(4)c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为( )
查看习题详情和答案>>
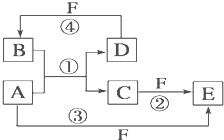 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).(1)若A为短周期金属单质,D为短周期非金属单质(一种黑色固体),且所含元素的原子序数A是D的2倍,原子的最外层电子数D是A的2倍,化合物F的浓溶液与单质A、D在一定条件下反应都有红棕色气体生成,则A在周期表中的位置为:
第三周期,ⅡA族
第三周期,ⅡA族
,B的电子式为::O::C::O:
:O::C::O:
,F的浓溶液与D在加热条件下反应的化学方程式为:C+4HNO3
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3
CO2↑+4NO2↑+2H2O
.
| ||
(2)若A是常见变价金属的单质,D、F是气态单质,且反应①②均在水溶液中进行.则反应②的离子方程式是
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
.(3)若A、D、F都是短周期非金属元素单质,且 A、D所含元素同主族,A、F所含元素同周期,B是制作光导纤维的基本原料,则B是
SiO2
SiO2
,C是CO
CO
,F是O2
O2
.(填化学式)