题目内容
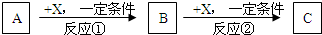
A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)

试回答:
(1)若X是强氧化性单质,则A 不可能是
a.S; b.N2;c.Na; d.Mg; e.Al
(2)若 A、B、C为烃的含氧衍生物,X为非金属单质,A与C反应生成D,D的相对分子质量为88,则C的官能团为
(3)若A、B、C为含有金属元素的无机化合物,X为强电解质,A 溶液与C溶液反应可生成B,则B的化学式可能为
(4)若 X 是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则A的电子式为
 ;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)
;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)

试回答:
(1)若X是强氧化性单质,则A 不可能是
de
de
.a.S; b.N2;c.Na; d.Mg; e.Al
(2)若 A、B、C为烃的含氧衍生物,X为非金属单质,A与C反应生成D,D的相对分子质量为88,则C的官能团为
羧基
羧基
,反应①的化学方程式为2CH3CH2OH+O2
2CH3CHO+2H2O
| 催化剂 |
| △ |
2CH3CH2OH+O2
2CH3CHO+2H2O
.| 催化剂 |
| △ |
(3)若A、B、C为含有金属元素的无机化合物,X为强电解质,A 溶液与C溶液反应可生成B,则B的化学式可能为
Al(OH)3
Al(OH)3
,X的化学式可能为 (写出不同类物质)NaOH(或KOH)
NaOH(或KOH)
或HCl
HCl
,反应①的离子方程式为Al3++3OH-=Al(OH)3↓
Al3++3OH-=Al(OH)3↓
或AlO2-+H++H2O=Al(OH)3↓
AlO2-+H++H2O=Al(OH)3↓
.(4)若 X 是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则A的电子式为


2Fe2++Fe=3Fe3+
2Fe2++Fe=3Fe3+
,检验此C溶液中金属元素价态的操作方法是用试管取少量C溶液,滴加KSCN溶液,无颜色变化,再滴加氯水(或硝酸),溶液呈红色,证明原溶液中有Fe2+存在
用试管取少量C溶液,滴加KSCN溶液,无颜色变化,再滴加氯水(或硝酸),溶液呈红色,证明原溶液中有Fe2+存在
.分析:(1)若X是强氧化性单质,A是单质,则A和X形成的化合物有变价元素;
(2)若 A、B、C为烃的含氧衍生物,X为非金属单质,A和B能被氧化,则X是氧气,A是醇,B是醛,C是羧酸,A与C反应生成D,D是酯,D的相对分子质量为88,则D是乙酸乙酯;
(3)若A、B、C为含有金属元素的无机化合物,X为强电解质,A 溶液与C溶液反应可生成B,则A和X的反应与量有关,且B是两性氢氧化物;
(4)若 X 是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则C中含有氯离子,且X是变价金属,则为铁,所以C是氯化亚铁,B是氯化铁,A是氯气;
亚铁离子不稳定,易被氧气氧化生成铁离子,铁离子能使硫氰化钾溶液呈血红色.
(2)若 A、B、C为烃的含氧衍生物,X为非金属单质,A和B能被氧化,则X是氧气,A是醇,B是醛,C是羧酸,A与C反应生成D,D是酯,D的相对分子质量为88,则D是乙酸乙酯;
(3)若A、B、C为含有金属元素的无机化合物,X为强电解质,A 溶液与C溶液反应可生成B,则A和X的反应与量有关,且B是两性氢氧化物;
(4)若 X 是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则C中含有氯离子,且X是变价金属,则为铁,所以C是氯化亚铁,B是氯化铁,A是氯气;
亚铁离子不稳定,易被氧气氧化生成铁离子,铁离子能使硫氰化钾溶液呈血红色.
解答:解:(1)若X是强氧化性单质,A是单质,则A和X形成的化合物有变价元素,
a.S和氧气反应生成二氧化硫,二氧化硫和氧气反应生成三氧化硫,所以符合转化关系;
b.N2和氧气反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,所以符合转化关系;
c.Na和氧气反应生成氧化钠,氧化钠和氧气反应生成过氧化钠,所以符合转化关系;
d.Mg和氧气反应生成氧化镁,氧化镁和氧气不反应,所以不符合转化关系;
e.Al和氧气反应生成氧化铝,氧化铝和氧气不反应,所以不符合转化关系;
故选d e;
(2)若 A、B、C为烃的含氧衍生物,X为非金属单质,A和B能被氧化,则X是氧气,A是醇,B是醛,C是羧酸,A与C反应生成D,D是酯,D的相对分子质量为88,则D是乙酸乙酯,所以C的官能团是羧基,在铜作催化剂、加热条件下,乙醇被氧化生成乙醛,反应方程式为:2CH3CH2OH+O2
2CH3CHO+2H2O,
故答案为:羧基,2CH3CH2OH+O2
2CH3CHO+2H2O;
(3)若A、B、C为含有金属元素的无机化合物,X为强电解质,A 溶液与C溶液反应可生成B,则A和X的反应与量有关,且B是氢氧化铝,A可能是氢氧化钠和盐酸,氯化铝和氢氧化钠反应生成氢氧化铝,偏铝酸根离子和酸反应生成氢氧化铝,离子反应方程式为:Al3++3OH-=Al(OH)3↓,AlO2-+H++H2O=Al(OH)3↓,
故答案为:Al(OH)3,NaOH(或KOH)、HCl(或其它强酸),Al3++3OH-=Al(OH)3↓;AlO2-+H++H2O=Al(OH)3↓;
(4)若 X 是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则C中含有氯离子,且X是变价金属,则为铁,所以C是氯化亚铁,B是氯化铁,A是氯气,氯气的电子式为: ,
,
亚铁离子易被氧气氧化生成铁离子而变质,为防止变质,C溶液在贮存时应加入少量X,铁和铁离子反应生成亚铁离子,离子反应方程式为:2Fe2++Fe=3Fe3+,铁离子和硫氰化钾溶液反应生成络合物而使溶液呈血红色,向溶液中滴加硫氰化钾溶液,如果溶液呈血红色,则证明含有铁离子,如果无颜色变化,再滴加氯水,溶液呈红色,则证明含有亚铁离子,
故答案为: ;2Fe2++Fe=3Fe3+;用试管取少量C溶液,滴加KSCN溶液,无颜色变化,再滴加氯水(或硝酸),溶液呈红色,证明原溶液中有Fe2+存在.
;2Fe2++Fe=3Fe3+;用试管取少量C溶液,滴加KSCN溶液,无颜色变化,再滴加氯水(或硝酸),溶液呈红色,证明原溶液中有Fe2+存在.
a.S和氧气反应生成二氧化硫,二氧化硫和氧气反应生成三氧化硫,所以符合转化关系;
b.N2和氧气反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,所以符合转化关系;
c.Na和氧气反应生成氧化钠,氧化钠和氧气反应生成过氧化钠,所以符合转化关系;
d.Mg和氧气反应生成氧化镁,氧化镁和氧气不反应,所以不符合转化关系;
e.Al和氧气反应生成氧化铝,氧化铝和氧气不反应,所以不符合转化关系;
故选d e;
(2)若 A、B、C为烃的含氧衍生物,X为非金属单质,A和B能被氧化,则X是氧气,A是醇,B是醛,C是羧酸,A与C反应生成D,D是酯,D的相对分子质量为88,则D是乙酸乙酯,所以C的官能团是羧基,在铜作催化剂、加热条件下,乙醇被氧化生成乙醛,反应方程式为:2CH3CH2OH+O2
| 催化剂 |
| △ |
故答案为:羧基,2CH3CH2OH+O2
| 催化剂 |
| △ |
(3)若A、B、C为含有金属元素的无机化合物,X为强电解质,A 溶液与C溶液反应可生成B,则A和X的反应与量有关,且B是氢氧化铝,A可能是氢氧化钠和盐酸,氯化铝和氢氧化钠反应生成氢氧化铝,偏铝酸根离子和酸反应生成氢氧化铝,离子反应方程式为:Al3++3OH-=Al(OH)3↓,AlO2-+H++H2O=Al(OH)3↓,
故答案为:Al(OH)3,NaOH(或KOH)、HCl(或其它强酸),Al3++3OH-=Al(OH)3↓;AlO2-+H++H2O=Al(OH)3↓;
(4)若 X 是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则C中含有氯离子,且X是变价金属,则为铁,所以C是氯化亚铁,B是氯化铁,A是氯气,氯气的电子式为:
 ,
,亚铁离子易被氧气氧化生成铁离子而变质,为防止变质,C溶液在贮存时应加入少量X,铁和铁离子反应生成亚铁离子,离子反应方程式为:2Fe2++Fe=3Fe3+,铁离子和硫氰化钾溶液反应生成络合物而使溶液呈血红色,向溶液中滴加硫氰化钾溶液,如果溶液呈血红色,则证明含有铁离子,如果无颜色变化,再滴加氯水,溶液呈红色,则证明含有亚铁离子,
故答案为:
 ;2Fe2++Fe=3Fe3+;用试管取少量C溶液,滴加KSCN溶液,无颜色变化,再滴加氯水(或硝酸),溶液呈红色,证明原溶液中有Fe2+存在.
;2Fe2++Fe=3Fe3+;用试管取少量C溶液,滴加KSCN溶液,无颜色变化,再滴加氯水(或硝酸),溶液呈红色,证明原溶液中有Fe2+存在.点评:本题考查物质推断,明确物质性质是解本题关键,考虑问题要全面,难度中等.

练习册系列答案
相关题目


 现有3种化合物A、B、C均含短周期元素R,其转化关系如图所示.
现有3种化合物A、B、C均含短周期元素R,其转化关系如图所示.