摘要:11.方程式配平后.ClO3-和Br-化学计量数之比为 A.1:1 B.1:2 C.1:3 D.1:5
网址:http://m.1010jiajiao.com/timu3_id_268866[举报]
某反应体系如下:
(1)请配平该离子方程式,并标出电子转移的方向和数目.
______Fe(OH)3+______ClO-+______OH-→______FeO
______Cl-+______H2O
完成配平后回答下列问题:
(2)已知有3.21g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=______;Fe
中铁元素为为______价.
(3)根据(1)和(2)推测FeO
能与下列哪些物质反应(填序号)______.
A.Cl2 B.SO2C、H2S D.O2.
查看习题详情和答案>>
(1)请配平该离子方程式,并标出电子转移的方向和数目.
______Fe(OH)3+______ClO-+______OH-→______FeO
| n-4 |
完成配平后回答下列问题:
(2)已知有3.21g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=______;Fe
| O | n-4 |
(3)根据(1)和(2)推测FeO
| n-4 |
A.Cl2 B.SO2C、H2S D.O2.
某反应体系如下:
(1)请配平该离子方程式,并标出电子转移的方向和数目.
______Fe(OH)3+______ClO-+______OH-→______FeO ______Cl-+______H2O
______Cl-+______H2O
完成配平后回答下列问题:
(2)已知有3.21g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=______;Fe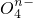 中铁元素为为______价.
中铁元素为为______价.
(3)根据(1)和(2)推测FeO 能与下列哪些物质反应(填序号)______.
能与下列哪些物质反应(填序号)______.
A.Cl2 B.SO2C、H2S D.O2.
查看习题详情和答案>>
某反应体系如下:
(1)请配平该离子方程式,并标出电子转移的方向和数目.
______Fe(OH)3+______ClO-+______OH-→______FeO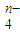 ______Cl-+______H2O
______Cl-+______H2O
完成配平后回答下列问题:
(2)已知有3.21g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=______;Fe 中铁元素为为______价.
中铁元素为为______价.
(3)根据(1)和(2)推测FeO 能与下列哪些物质反应(填序号)______.
能与下列哪些物质反应(填序号)______.
A.Cl2 B.SO2C、H2S D.O2.
查看习题详情和答案>>
(1)请配平该离子方程式,并标出电子转移的方向和数目.
______Fe(OH)3+______ClO-+______OH-→______FeO
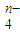 ______Cl-+______H2O
______Cl-+______H2O完成配平后回答下列问题:
(2)已知有3.21g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=______;Fe
 中铁元素为为______价.
中铁元素为为______价.(3)根据(1)和(2)推测FeO
 能与下列哪些物质反应(填序号)______.
能与下列哪些物质反应(填序号)______.A.Cl2 B.SO2C、H2S D.O2.
查看习题详情和答案>>
 (2013?江西模拟)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、Cl
(2013?江西模拟)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、Cl| O | - 3 |
| O | - 3 |
(1)t1前,氧化产物是
Ca(ClO)2
Ca(ClO)2
(填化学式).(2)t2时,Ca(OH)2与Cl2发生反应的总的离子方程式为:
5Ca(OH)2+5Cl2=5Ca2++2ClO-+ClO3-+7Cl-+5H2O
5Ca(OH)2+5Cl2=5Ca2++2ClO-+ClO3-+7Cl-+5H2O
.(3)该石灰乳中含有Ca(OH)2的物质的量是
5
5
mol.(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是
D
D
(填字母).A.NaCl、Cl2 B.NaCl、NaClO C.NaClO3、NaClO4 D.NaCl、NaClO3
(5)配平下列离子方程式:
2
2
Fe(OH)3+(5-n)
(5-n)
ClO-+2n
2n
OH-----2
2
Fe| O | n- 4 |
(5-n)
(5-n)
Cl-+(n+3)
(n+3)
H2O.高铁酸钾(K2FeO4)具有极高的氧化性,且其还原产物为铁锈,对环境无不良影响.因该物质具有“绿色”、选择性高、活性强等特点受到人们关注.
I、高铁酸钾制备方法之一为:①在一定温度下,将氯气通入KOH溶液中制得次氯酸钾溶液;②在剧烈搅拌条件下,将Fe(NO3)3分批加入次氯酸钾溶液中,控制反应温度,以免次氯酸钾分解;③加 KOH至饱和,使K2FeO4 充分析出,再经纯化得产品,其纯度在95%以上.
(1)氯碱工业中制备氯气的化学方程式是 ;
(2)温度过高会导致次氯酸钾分解生成两种化合物,产物之一是氯酸钾(KClO3),另一种产物应该是 (写化学式)
(3)制备过程有一步反应如下,请配平此方程式(将计量数填入方框中):
Fe(OH)3+ ClO-+ OH-═ Fe
+ Cl-+ H2O
Ⅱ、为探究高铁酸钾的某种性质,进行如下两个实验:
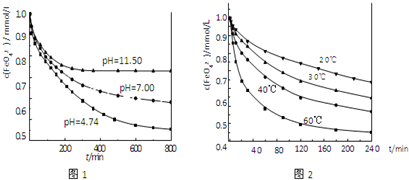
实验1:将适量K2FeO4分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0mmol?L-1(1mmol?L-1=10-3mol?L-1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800min后,三种溶液中高铁酸钾的浓度不再改变).
实验2:将适量 K2FeO4 溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为 1.0mmol?L-1 的试样,将试样分别置于 20℃、30℃、40℃和 60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2.
(4)实验1的目的是 ;
(5)实验2可得出的结论是 ;
(6)高铁酸钾在水中的反应为4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.
由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 ;
Ⅲ、高铁酸钾还是高能电池的电极材料.例如,Al-K2FeO4电池就是一种高能电池(以氢氧化钾溶液为电解质溶液),该电池放电时负极反应式是 .
查看习题详情和答案>>
I、高铁酸钾制备方法之一为:①在一定温度下,将氯气通入KOH溶液中制得次氯酸钾溶液;②在剧烈搅拌条件下,将Fe(NO3)3分批加入次氯酸钾溶液中,控制反应温度,以免次氯酸钾分解;③加 KOH至饱和,使K2FeO4 充分析出,再经纯化得产品,其纯度在95%以上.
(1)氯碱工业中制备氯气的化学方程式是
(2)温度过高会导致次氯酸钾分解生成两种化合物,产物之一是氯酸钾(KClO3),另一种产物应该是
(3)制备过程有一步反应如下,请配平此方程式(将计量数填入方框中):
| O | 2- 4 |
Ⅱ、为探究高铁酸钾的某种性质,进行如下两个实验:

实验1:将适量K2FeO4分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0mmol?L-1(1mmol?L-1=10-3mol?L-1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800min后,三种溶液中高铁酸钾的浓度不再改变).
实验2:将适量 K2FeO4 溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为 1.0mmol?L-1 的试样,将试样分别置于 20℃、30℃、40℃和 60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2.
(4)实验1的目的是
(5)实验2可得出的结论是
(6)高铁酸钾在水中的反应为4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.
由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是
Ⅲ、高铁酸钾还是高能电池的电极材料.例如,Al-K2FeO4电池就是一种高能电池(以氢氧化钾溶液为电解质溶液),该电池放电时负极反应式是