题目内容
某反应体系如下:
(1)请配平该离子方程式,并标出电子转移的方向和数目.
______Fe(OH)3+______ClO-+______OH-→______FeO
______Cl-+______H2O
完成配平后回答下列问题:
(2)已知有3.21g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=______;Fe
中铁元素为为______价.
(3)根据(1)和(2)推测FeO
能与下列哪些物质反应(填序号)______.
A.Cl2 B.SO2C、H2S D.O2.
(1)请配平该离子方程式,并标出电子转移的方向和数目.
______Fe(OH)3+______ClO-+______OH-→______FeO
| n-4 |
完成配平后回答下列问题:
(2)已知有3.21g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=______;Fe
| O | n-4 |
(3)根据(1)和(2)推测FeO
| n-4 |
A.Cl2 B.SO2C、H2S D.O2.
(1)反应中铁元素的化合价从+3价降低为8-n价,化合价降低了5-n价,Cl元素的化合价从+1价降为-1价,化合价升高了2价,根据电子守恒,氢氧化铁前面的系数是2,次氯酸根前面的系数是5-n,根据原子守恒,所以FeO4n-前面的系数是2,据电荷守恒,氢氧根前面系数是2n,H2O前面的系数是n+3,
故答案为:2;5-n;2n;2;5-n;n+3;
(2)有3.21g即0.03molFe(OH)3参加反应,共转移了5.42×1022个即0.09mol电子,所以n=2;FeO4n-中铁元素为为+6,故答案为:2;+6;
(3)FeO4n-中铁元素为为+6,居于最高价,具有强氧化性,可以与具有还原性的物质反应,故答案为:BC.
故答案为:2;5-n;2n;2;5-n;n+3;
(2)有3.21g即0.03molFe(OH)3参加反应,共转移了5.42×1022个即0.09mol电子,所以n=2;FeO4n-中铁元素为为+6,故答案为:2;+6;
(3)FeO4n-中铁元素为为+6,居于最高价,具有强氧化性,可以与具有还原性的物质反应,故答案为:BC.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
 含放射性的131I的碘〔131I〕化钠口服溶液在临床医学上常用于治疗甲亢.某碘〔131I〕化钠口服溶的说明书摘录(部分)如图,按要求回答下列问题.
含放射性的131I的碘〔131I〕化钠口服溶液在临床医学上常用于治疗甲亢.某碘〔131I〕化钠口服溶的说明书摘录(部分)如图,按要求回答下列问题. ______Cl-+______H2O
______Cl-+______H2O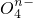 中铁元素为为______价.
中铁元素为为______价.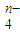 ______Cl-+______H2O
______Cl-+______H2O 中铁元素为为______价.
中铁元素为为______价. 能与下列哪些物质反应(填序号)______.
能与下列哪些物质反应(填序号)______.