网址:http://m.1010jiajiao.com/timu3_id_268820[举报]
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体[FeSO4·7H2O]和胆矾晶体,以探索工业废料的再利用.其实验方案如下:
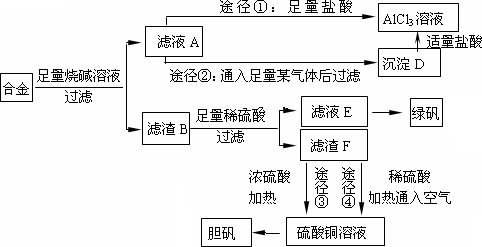
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式________.
(2)由滤液A制AlCl3溶液的途径有①和②两种,你认为合理的是________.上述实验方案多处采用了过滤操作,过滤所用到的玻璃仪器有________和玻璃棒;其中玻璃棒的作用是________.
(3)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是________、________.
(4)通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、________、冷却结晶、________、自然干燥.其中“加热通氧气”所起的作用为________(用离子方程式表示).
(5)测定所得胆矾(CuSO4·xH2O)中x值的实验方案是蒸发硫酸铜晶体中的水得到白色的无水硫酸铜,冷却后称量.此变化的化学方程式为:CuSO4·xH2O![]() CuSO4+xH2O,但温度过高,CuSO4会继续分解为CuO和SO3.在此实验过程中,称量操作至少进行________次.若测定结果x值偏高,可能的原因是________.
CuSO4+xH2O,但温度过高,CuSO4会继续分解为CuO和SO3.在此实验过程中,称量操作至少进行________次.若测定结果x值偏高,可能的原因是________.
a.加热温度过高
b.加热时胆矾晶体飞溅出来
c.加热后放在空气中冷却
d.所用坩埚事先未干燥(潮湿)
铝是一种重要的金属.
(1)铝在元素周期表中的位置是________.
(2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为________.
(3)铝与NaOH溶液反应的离子方程式为________;同温同压下,在浓度和体积均为100 mL 2 mol/L的盐酸及NaOH溶液中各加入等质量和Al,产生气体的体积比为5∶6,则所加Al的质量为________.
(4)以上述所得AlCl3溶液为原料制取无水AlCl3,先制得AlCl3·6H2O晶体,主要操作包括________,在干燥的HCl气流中加热AlCl3·6H2O晶体,能进一步制取无水AlCl3,其原因是(结合离子方程式简要说明)________.
| 元素 | 信息 |
| X | 所在主族序数与所在周期序数之差为4 |
| Y | 最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
| Z | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
| W | 该元素能形成两性氢氧化物 |
(1)W的单质与Y的最高价氧化物对应的水化物反应的离子方程式为
(2)铜片、碳棒和ZX3溶液组成原电池,写出正极发生的电极反应方程式
(3)向淀粉碘化钾溶液中滴加几滴ZX3的浓溶液,现象为


(4)以上述所得WX3溶液为原料制取无水WX3,先制得WX3?6H2O晶体,主要操作包括
铝是一种重要的金属。
(1)铝在元素周期表中的位置是__________。
(2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为__________________________。
(3)铝与NaOH溶液反应的离子方程式为____________________________;同温同压下,在浓度和体积均为100 mL 2 mol/L的盐酸及NaOH溶液中加入等质量的Al,产生气体的体积比为5∶6,则所加Al的质量为__________。
(4)以上述所得AlCl3溶液为原料制取无水AlCl3,先制得AlCl3·6H2O晶体,主要操作包括________________________,在干燥的HCl气流中加热AlCl3·6H2O晶体,能进一步制取无水AlCl3,其原因是(结合离子方程式简要说明) ______________________。
查看习题详情和答案>>