题目内容
铝是一种重要的金属。
(1)铝在元素周期表中的位置是 。
(2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为 。
(3)铝与NaOH溶液反应的离子方程式为 ;同温同压下,在浓度和体积均为100mL 2mol/L的盐酸及NaOH溶液中各加入等质量和Al,产生气体的体积比为5:6,则所加Al的质量为 。
(4)以上述所得AlCl3溶液为原料制取无水AlCl3,先制得AlCl3?6H2O晶体,主要操作包括 ,在干燥的HCl气流中加热AlCl3?6H2O晶体,能进一步制取无水AlCl3,其原因是(结合离子方程式简要说明) 。
(1)3周期,ⅢA族
(2)2Al + Fe2O3 ![]() Al2O3 + 2Fe
Al2O3 + 2Fe
(3)2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑; 2.16g
(4)加热浓缩,冷却结晶,过滤; Al3+ + 3H2O![]() Al(OH)3 + 3H+,在干燥的HCl气流中,可抑制AlCl3的水解,且带走AlCl3?6H2O晶体受热产生的水蒸气,故能得到无水AlCl3。
Al(OH)3 + 3H+,在干燥的HCl气流中,可抑制AlCl3的水解,且带走AlCl3?6H2O晶体受热产生的水蒸气,故能得到无水AlCl3。

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
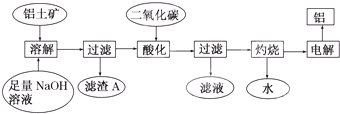
 铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程: