摘要:烃甲的式量为128.且属于芳香烃.则甲的结构简式为 ,烃乙与甲式量相 同.且乙燃烧时生成的水是等物质的量乙烯燃烧时生成水的5倍.乙的分子式为 .若乙的一氯代物的同分异构体只有两种.则乙的结构简式为
网址:http://m.1010jiajiao.com/timu3_id_268797[举报]
已知某有机物烃A的式量为92,则A的化学式为________________,又知A不能使溴水褪色,但能使酸性KMnO4(aq)褪色,则A的结构简式为________________.
查看习题详情和答案>>
已知某有机物烃A的式量为92,则A的化学式为________________,又知A不能使溴水褪色,但能使酸性KMnO4(aq)褪色,则A的结构简式为________________.
查看习题详情和答案>>
已知某有机物的式量为58,根据下列条件,回答:
(1)若该有机物为烃,则可能的结构简式为
(2)若为含氧衍生物,且分子中有-CH3,则可能的结构简式为(任写2种)
(3)若分子中无-CH3,又无-OH,但能发生银镜反应,则可能的结构简式为
(4)分子中有-OH,无C=C,则结构简式为
 .
.
查看习题详情和答案>>
(1)若该有机物为烃,则可能的结构简式为
CH3CH2CH2CH3或CH3CH(CH3)CH3.
CH3CH2CH2CH3或CH3CH(CH3)CH3.
.(2)若为含氧衍生物,且分子中有-CH3,则可能的结构简式为(任写2种)
CH3CH2CHO或CH3COCH3
CH3CH2CHO或CH3COCH3
.(3)若分子中无-CH3,又无-OH,但能发生银镜反应,则可能的结构简式为
OHCCHO
OHCCHO
.(4)分子中有-OH,无C=C,则结构简式为


(2011?江山市模拟)(背景材料)氮化铝(AlN)陶瓷是一种类金刚石氮化物的新型无机非金属材料,最高可稳定到2200℃.导热性好,热膨胀系数小,是良好的耐热冲击材料.抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料.氮化铝还是电绝缘体,介电性能良好,用作电器元件也很有希望.超细氮化铝粉末被广泛应用于大规模集成电路生产领域.其制取原理为:
Al2O3+3C+N2
2AlN+3CO
(问题探究)某化学研究性学习小组成员根据氮化铝的制取原理,进行了如下探究.
问题1、在制取氮化铝时由于反应不完全,氮化铝产品中所含杂质除了碳以外还可能存在
问题2、为测定该产品中有关成分的含量,甲、乙两同学设计了以下两个实验:
(1)甲同学:称取10.00g样品,将其加入过量的氢氧化钠溶液中共热并蒸干,AlN跟氢氧化钠溶液反应生成NaAlO2,并放出氨气3.36L(标准状况).
①上述反应的化学方程式为
②该样品中的AlN的质量分数为
(2)乙同学:称取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g?L-1(已折成标准状况,AlN不跟O2反应).该样品中含杂质碳
问题3、丙同学受到甲、乙同学实验的启发,认为测定某氮化铝中含有碳或氧化铝杂质,可用图中I的一些装置来进行检验,根据AlN与NaOH溶液反应所生成氨气的体积来测定样品中氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)
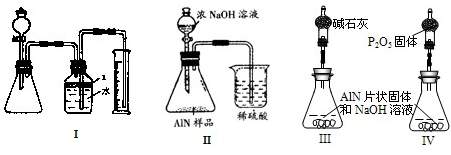
(1)实验有关操作为:①往锥形瓶中放入适量的AlN样品:②从分液漏斗往锥形瓶中加入过量的浓NaOH;③检验装置的气密性;④测定收集到水的体积.
正确的操作顺序为
(2)本试验中检查装置气密性的方法是
(3)广口瓶中的试剂X可最好选用
A、苯 B、酒精 C、植物油 D、CCl4
(4)广口瓶的液体没有装满(上方留有少量空间),实验测得NH3的体积将
(5)若实验中测得样品的质量为wg,氨气的体积为aL(标况下),则样品中AlN的质量分数为
%
%(AlN的式量为41).
(6)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是
问题4、丁同学认为,丙同学的实验方法,可能因气体体积测量不准,导致误差较大.建议改用图9中的Ⅱ装置进行同样实验,通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数.你认为是否可行?
问题5、戊同学仔细思考了丁同学的装置后,认为此装置所测测得的样品中AlN含量偏小.其原因是
查看习题详情和答案>>
Al2O3+3C+N2
| 高温 |
(问题探究)某化学研究性学习小组成员根据氮化铝的制取原理,进行了如下探究.
问题1、在制取氮化铝时由于反应不完全,氮化铝产品中所含杂质除了碳以外还可能存在
氧化铝
氧化铝
.问题2、为测定该产品中有关成分的含量,甲、乙两同学设计了以下两个实验:
(1)甲同学:称取10.00g样品,将其加入过量的氢氧化钠溶液中共热并蒸干,AlN跟氢氧化钠溶液反应生成NaAlO2,并放出氨气3.36L(标准状况).
①上述反应的化学方程式为
AlN+NaOH+H2O=NaAlO2+NH3↑
AlN+NaOH+H2O=NaAlO2+NH3↑
.②该样品中的AlN的质量分数为
61.5%
61.5%
.(2)乙同学:称取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g?L-1(已折成标准状况,AlN不跟O2反应).该样品中含杂质碳
1.92
1.92
g.问题3、丙同学受到甲、乙同学实验的启发,认为测定某氮化铝中含有碳或氧化铝杂质,可用图中I的一些装置来进行检验,根据AlN与NaOH溶液反应所生成氨气的体积来测定样品中氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)

(1)实验有关操作为:①往锥形瓶中放入适量的AlN样品:②从分液漏斗往锥形瓶中加入过量的浓NaOH;③检验装置的气密性;④测定收集到水的体积.
正确的操作顺序为
③①②④
③①②④
.(2)本试验中检查装置气密性的方法是
关闭分液漏斗活塞,微热锥形瓶,广口瓶中右侧导管水柱上升,恒温时水柱并不回落
关闭分液漏斗活塞,微热锥形瓶,广口瓶中右侧导管水柱上升,恒温时水柱并不回落
.(3)广口瓶中的试剂X可最好选用
C
C
(填选项的标号).A、苯 B、酒精 C、植物油 D、CCl4
(4)广口瓶的液体没有装满(上方留有少量空间),实验测得NH3的体积将
不变
不变
(填偏大、偏小或不变).(5)若实验中测得样品的质量为wg,氨气的体积为aL(标况下),则样品中AlN的质量分数为
| 4100a |
| 22.4w |
| 4100a |
| 22.4w |
(6)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是
碳
碳
,为了测定是否含有其它杂质,则还需要哪些简单数据碳的质量
碳的质量
.问题4、丁同学认为,丙同学的实验方法,可能因气体体积测量不准,导致误差较大.建议改用图9中的Ⅱ装置进行同样实验,通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数.你认为是否可行?
不可行
不可行
(填入“可行”、“不可行”),原因是II中NH3极易被吸收,发生倒吸现象,同时氨气中含有水蒸气,影响氨气质量的测定
II中NH3极易被吸收,发生倒吸现象,同时氨气中含有水蒸气,影响氨气质量的测定
.最简单的改进方法为在装置之间添加盛有碱石灰的干燥管,烧杯导管的末端接一倒扣的漏斗来吸收氨气
在装置之间添加盛有碱石灰的干燥管,烧杯导管的末端接一倒扣的漏斗来吸收氨气
.问题5、戊同学仔细思考了丁同学的装置后,认为此装置所测测得的样品中AlN含量偏小.其原因是
反应产生的氨气不可能被完全吸收
反应产生的氨气不可能被完全吸收
.若忽略此原因的话,只要用图9中的III或IV两个装置中的一种,只需进行简单而又必要的数据测定,可比较准确地确定样品中AlN的质量分数.较合理的装置为Ⅲ
Ⅲ
(填代号).你认为戊同学的装置是否还有缺陷?有
有
.若有,所测结果将偏高或偏低偏低
偏低
,应作如何改进?应再接一个与IV装置中完全相同的干燥管(或再接一个装有碱石灰的干燥管也行)
应再接一个与IV装置中完全相同的干燥管(或再接一个装有碱石灰的干燥管也行)
.(若无缺陷后两此格可不填).草酸亚铁用作分析试剂及显影剂等,其制备流程如图甲:
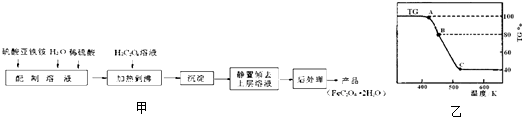
(1)配制(NH4)2Fe(SO4)2?6H2O溶液时,需加少量稀硫酸,目的是
(2)将制得的产品在氩气气氛中进行热重分析,结果如图乙(TG%表示残留固体质量占原样品总质量的百分数,Fe(SO4)2?2H2O的式量为180).
①A→B发生反应的化学方程式为
②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO.加热至1100℃,其中FeO(s)+CO(g)?Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?
查看习题详情和答案>>

(1)配制(NH4)2Fe(SO4)2?6H2O溶液时,需加少量稀硫酸,目的是
抑制Fe2+水解
抑制Fe2+水解
.(2)将制得的产品在氩气气氛中进行热重分析,结果如图乙(TG%表示残留固体质量占原样品总质量的百分数,Fe(SO4)2?2H2O的式量为180).
①A→B发生反应的化学方程式为
FeC2O4.2H2O(s)
FeC2O4(s)+2H2O(g)
| ||
FeC2O4.2H2O(s)
FeC2O4(s)+2H2O(g)
.C处时残留物的化学式为
| ||
FeO
FeO
.②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:
3FeO+H2O
Fe3O4+H2
| ||
3FeO+H2O
Fe3O4+H2
.
| ||
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO.加热至1100℃,其中FeO(s)+CO(g)?Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?
71.4%
71.4%
.