题目内容
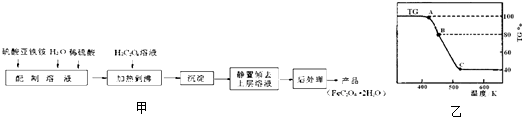
草酸亚铁用作分析试剂及显影剂等,其制备流程如图甲:
(1)配制(NH4)2Fe(SO4)2?6H2O溶液时,需加少量稀硫酸,目的是
(2)将制得的产品在氩气气氛中进行热重分析,结果如图乙(TG%表示残留固体质量占原样品总质量的百分数,Fe(SO4)2?2H2O的式量为180).
①A→B发生反应的化学方程式为
②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO.加热至1100℃,其中FeO(s)+CO(g)?Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?

(1)配制(NH4)2Fe(SO4)2?6H2O溶液时,需加少量稀硫酸,目的是
抑制Fe2+水解
抑制Fe2+水解
.(2)将制得的产品在氩气气氛中进行热重分析,结果如图乙(TG%表示残留固体质量占原样品总质量的百分数,Fe(SO4)2?2H2O的式量为180).
①A→B发生反应的化学方程式为
FeC2O4.2H2O(s)
FeC2O4(s)+2H2O(g)
| ||
FeC2O4.2H2O(s)
FeC2O4(s)+2H2O(g)
.C处时残留物的化学式为
| ||
FeO
FeO
.②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:
3FeO+H2O
Fe3O4+H2
| ||
3FeO+H2O
Fe3O4+H2
.
| ||
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO.加热至1100℃,其中FeO(s)+CO(g)?Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?
71.4%
71.4%
.分析:(1)溶液中亚铁离子水解,加入少量硫酸,抑制亚铁离子水解;
(2)①由图可知,加热生成B时剩余固体为80%,损失20%,FeC2O4.2H2O中结晶水的质量为
×100%=20%,故A→B发生反应是FeC2O4.2H2O加热失去结晶水;
由图可知加热生成C时,分解完全,假定草酸亚铁晶体为180g,其物质的量为1mol,则C固体的质量为180g×40%=72g,铁元素质量为1mol×56g/mol=56,故应含有氧元素为72g-56g=16g,即铁原子与氧原子物质的量之比为1:1,应为FeO;
②气相色谱还检出H2,最终产物中也有微量的磁性物质生成,磁性物质为四氧化三铁,可能是FeO与水反应生成四氧化三铁与氢气;
③由①分析可知,加热发生反应FeC2O4(s)
FeO+CO(g)+CO2,计算FeC2O4分解生成FeO、CO、二氧化碳的物质的量,令参加反应的CO的物质的量为xmol,利用三段式计算平衡时各组分的物质的量,利用物质的量代替浓度代入平衡常数表达式列方程计算x的值,进而计算FeO转化率.
(2)①由图可知,加热生成B时剩余固体为80%,损失20%,FeC2O4.2H2O中结晶水的质量为
| 36 |
| 180 |
由图可知加热生成C时,分解完全,假定草酸亚铁晶体为180g,其物质的量为1mol,则C固体的质量为180g×40%=72g,铁元素质量为1mol×56g/mol=56,故应含有氧元素为72g-56g=16g,即铁原子与氧原子物质的量之比为1:1,应为FeO;
②气相色谱还检出H2,最终产物中也有微量的磁性物质生成,磁性物质为四氧化三铁,可能是FeO与水反应生成四氧化三铁与氢气;
③由①分析可知,加热发生反应FeC2O4(s)
| ||
解答:解:(1)溶液中亚铁离子水解,加入少量硫酸,抑制亚铁离子水解,
故答案为:抑制Fe2+水解;
(2)①由图可知,加热生成B时剩余固体为80%,损失20%,FeC2O4.2H2O中结晶水的质量为
×100%=20%,故A→B发生反应是FeC2O4.2H2O加热失去结晶水,反应方程式为:FeC2O4.2H2O(s)
FeC2O4(s)+2H2O(g),
由图可知加热生成C时,分解完全,假定草酸亚铁晶体为180g,其物质的量为1mol,则C固体的质量为180g×40%=72g,铁元素质量为1mol×56g/mol=56,故应含有氧元素为72g-56g=16g,氧原子物质的量为1mol,即铁原子与氧原子物质的量之比为1:1,应为FeO,
故答案为:FeC2O4.2H2O(s)
FeC2O4(s)+2H2O(g);FeO
②气相色谱还检出H2,最终产物中也有微量的磁性物质生成,磁性物质为四氧化三铁,可能是FeO与水反应生成四氧化三铁与氢气,反应方程式为:3FeO+H2O
Fe3O4+H2,
故答案为:3FeO+H2O
Fe3O4+H2;
③FeC2O4(s)
FeO+CO(g)+CO2(g)
144g 1mol 1mol 1mol
1.44g 0.01mol 0.01mol 0.01mol
CO总物质的量为0.01mol+0.04mol,
令参加反应的CO的物质的量为xmol,则:
FeO(s)+CO(g)?Fe(s)+CO2(g)
开始(mol):0.01 0.05 0.01
变化(mol):x x x
平衡(mol):0.01-x 0.05-x 0.01+x
则
=0.4,解得x=
,
故FeO的转化率=
×100%=71.4%,
故答案为:71.4%.
故答案为:抑制Fe2+水解;
(2)①由图可知,加热生成B时剩余固体为80%,损失20%,FeC2O4.2H2O中结晶水的质量为
| 36 |
| 180 |
| ||
由图可知加热生成C时,分解完全,假定草酸亚铁晶体为180g,其物质的量为1mol,则C固体的质量为180g×40%=72g,铁元素质量为1mol×56g/mol=56,故应含有氧元素为72g-56g=16g,氧原子物质的量为1mol,即铁原子与氧原子物质的量之比为1:1,应为FeO,
故答案为:FeC2O4.2H2O(s)
| ||
②气相色谱还检出H2,最终产物中也有微量的磁性物质生成,磁性物质为四氧化三铁,可能是FeO与水反应生成四氧化三铁与氢气,反应方程式为:3FeO+H2O
| ||
故答案为:3FeO+H2O
| ||
③FeC2O4(s)
| ||
144g 1mol 1mol 1mol
1.44g 0.01mol 0.01mol 0.01mol
CO总物质的量为0.01mol+0.04mol,
令参加反应的CO的物质的量为xmol,则:
FeO(s)+CO(g)?Fe(s)+CO2(g)
开始(mol):0.01 0.05 0.01
变化(mol):x x x
平衡(mol):0.01-x 0.05-x 0.01+x
则
| 0.01+x |
| 0.05-x |
| 1 |
| 140 |
故FeO的转化率=
| ||
| 0.01mol |
故答案为:71.4%.
点评:本题以草酸亚铁制备为载体,考查盐类水解、化学计算推断物质、化学平衡计算,根据计算判断各阶段发生的反应是解题的关键,(5)为易错点,容易忽略草酸亚铁分解生成的一氧化碳、二氧化碳,难度较大.

练习册系列答案
相关题目

 6H2O溶液时,需加少量稀硫酸,目的是________________________________________________________。
6H2O溶液时,需加少量稀硫酸,目的是________________________________________________________。
 B发生反应的化学方程式为
B发生反应的化学方程式为 Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?____________________________。
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?____________________________。
 6H2O溶液时,需加少量稀硫酸,目的是 。
6H2O溶液时,需加少量稀硫酸,目的是 。
 Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? 。
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? 。

 6H2O溶液时,需加少量稀硫酸,目的是
。
6H2O溶液时,需加少量稀硫酸,目的是
。
 Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? 。
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少? 。