摘要:(8)一定条件下.把3molN2和3molH2通入一个一定容积的密闭容器中.发生反应生成氨气.达到平衡时.氨的浓度为Xmol/L.N2的转化率为M.则 (1) H2的转化率___M(填“大于 “小于 或“无法确定 ) (2) 若在上述完全相同的容器中.维持温度不变.通入amolNH3,bmolN2,cmolH2,要使氨的浓度仍为Xmol/L.若a=1,则b= ,c= , (3) 达到平衡时.氢气和氨气均为1.5摩尔.你认为是否可能___(填“可能 “不可能 或“无法确定 )
网址:http://m.1010jiajiao.com/timu3_id_267636[举报]
2011年12月13日,加拿大正式宣布将退出《京都议定书》,这使CO2的排放问题再次成为了热点.当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
I.最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,在一定条件下与H2反应,使之变为可再生燃料甲醇.其流程如图1所示:

①上述流程中碳酸钾溶液所起的作用是
②在分解池中发生的反应为
Ⅱ.碳酸钾是重要的无机化工、医药、轻工原料之一,主要用于医药、玻璃、染料等工业,可用作气体吸附剂,干粉灭火剂,橡胶防老剂等.
已知:CO2、碳酸盐、碳酸氢盐的部分性质如下:
CO2(过量)+OH-═HCO3- HCO3-+OH-═CO32-+H2O
CO32-与H+反应生成CO2分两步:
CO32-+H+═HCO3-; HCO3-+H+═H2O+CO2↑
①小王同学在实验室用如图2所示的装置和药品制取K2CO3溶液.他所制得的溶液中可能含有的杂质是
②现有100ml氢氧化钾溶液,请你设计一方案,使其尽可能完全转化为碳酸钾溶液(只需列出实验步骤)
③该同学在数字实验室中用传感器对碳酸钾和碳酸氢钾的混合物样品进行成分测定,他分别称取三份不同质量的混合物样品,配成稀溶液,然后分别逐滴加入相同浓度的50ml硫酸,测得如下数据:
试计算:该混合固体中K2CO3与KHCO3的物质的量之比是
查看习题详情和答案>>
I.最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,在一定条件下与H2反应,使之变为可再生燃料甲醇.其流程如图1所示:

①上述流程中碳酸钾溶液所起的作用是
吸收或富集二氧化碳
吸收或富集二氧化碳
.②在分解池中发生的反应为
2KHCO3
K2CO3+CO2↑+H2O
| ||
2KHCO3
K2CO3+CO2↑+H2O
(写出化学方程式).
| ||
Ⅱ.碳酸钾是重要的无机化工、医药、轻工原料之一,主要用于医药、玻璃、染料等工业,可用作气体吸附剂,干粉灭火剂,橡胶防老剂等.
已知:CO2、碳酸盐、碳酸氢盐的部分性质如下:
CO2(过量)+OH-═HCO3- HCO3-+OH-═CO32-+H2O
CO32-与H+反应生成CO2分两步:
CO32-+H+═HCO3-; HCO3-+H+═H2O+CO2↑
①小王同学在实验室用如图2所示的装置和药品制取K2CO3溶液.他所制得的溶液中可能含有的杂质是
碳酸氢钾或氢氧化钾
碳酸氢钾或氢氧化钾
.②现有100ml氢氧化钾溶液,请你设计一方案,使其尽可能完全转化为碳酸钾溶液(只需列出实验步骤)
通入过量的二氧化碳使其充分反应,然后蒸发结晶得到碳酸氢钾,再将所得固体加热分解,将分解后的固体溶于水
通入过量的二氧化碳使其充分反应,然后蒸发结晶得到碳酸氢钾,再将所得固体加热分解,将分解后的固体溶于水
.③该同学在数字实验室中用传感器对碳酸钾和碳酸氢钾的混合物样品进行成分测定,他分别称取三份不同质量的混合物样品,配成稀溶液,然后分别逐滴加入相同浓度的50ml硫酸,测得如下数据:
| 实验编号 | 1 | 2 | 3 |
| 混合物的质量/g | 3.76 | 4.70 | 8.46 |
| 硫酸溶液的体积/mL | 50.00 | 50.00 | 50.00 |
| 生成二氧化碳的物质的量/mol | 0.03 | 0.0375 | 0.03 |
2:1
2:1
;所用硫酸的物质的量浓度为0.75
0.75
mol?L-1.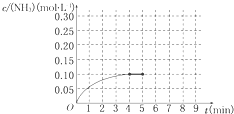 在一容积为2L的密闭容器内为加入 0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图所示:
在一容积为2L的密闭容器内为加入 0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图所示:(1)反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
A.0.20mol?L-1 B.0.12mol?L-1
C.0.10mol?L-1 D.0.08mol?L-1
(2)反应达到平衡后,第5分钟末,保持其他条件不变,若只把容器的体积缩小一半,平衡
(3)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol?L-1).请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
(2009?滨州模拟)在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g)
2NH3(g)△HPO反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题;

(1)根据如图,计算从反应开始到平衡时,平均反应速率v(NH3)为
(2)该反应的化学平衡常数表达式K
.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
a 0.20mol?L-1 b 0.12mol?L-1 c 0.10mol?L-1 d 0.08mol?L-1
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡
(6)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol?L-1 ),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
查看习题详情和答案>>
N2(g)+3H2(g)
| ||

(1)根据如图,计算从反应开始到平衡时,平均反应速率v(NH3)为
0.025mol/(L?min)
0.025mol/(L?min)
.(2)该反应的化学平衡常数表达式K
| c2(NH3) |
| c(N2)×c3(H2) |
| c2(NH3) |
| c(N2)×c3(H2) |
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
ac
ac
.(填序号).a 0.20mol?L-1 b 0.12mol?L-1 c 0.10mol?L-1 d 0.08mol?L-1
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡
向正反应方向
向正反应方向
移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数不变
不变
(填“增大”、“减少”或“不变”).(6)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol?L-1 ),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
 (2012?唐山二模)【化学--选修物质结构与性质】
(2012?唐山二模)【化学--选修物质结构与性质】(1)目前,利用金属或合金储氢的研究已取得很大进步,右图是一种镍基合金储氢后的晶胞结构图.
①Ni原子的价电子排布式是
3d84s2
3d84s2
.②该合金储氢后,含1mol La的合金可吸附H2的数目为
3NA
3NA
.(2)某化学实验室合成了一种多功能材料--对硝基苯酚水合物X(化学式为C6H5NO3?l.5H2O).实验表明,加热至94℃时X能失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色.
①X中四种基本元素的电负性由大到小的顺序是
O>N>C>H
O>N>C>H
.②X中四种基本元素中第一电离能最高的元素的原子的轨道表示式为


③X失去结晶水的过程中,破坏的微粒间作用力是
氢键
氢键
,(3)科学家把NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO2-4互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构.
该阴离子的电子式是


sp3
sp3
.