题目内容
 (2012?唐山二模)【化学--选修物质结构与性质】
(2012?唐山二模)【化学--选修物质结构与性质】(1)目前,利用金属或合金储氢的研究已取得很大进步,右图是一种镍基合金储氢后的晶胞结构图.
①Ni原子的价电子排布式是
3d84s2
3d84s2
.②该合金储氢后,含1mol La的合金可吸附H2的数目为
3NA
3NA
.(2)某化学实验室合成了一种多功能材料--对硝基苯酚水合物X(化学式为C6H5NO3?l.5H2O).实验表明,加热至94℃时X能失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色.
①X中四种基本元素的电负性由大到小的顺序是
O>N>C>H
O>N>C>H
.②X中四种基本元素中第一电离能最高的元素的原子的轨道表示式为


③X失去结晶水的过程中,破坏的微粒间作用力是
氢键
氢键
,(3)科学家把NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO2-4互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构.
该阴离子的电子式是


sp3
sp3
.分析:(1)①Ni是28号元素,其核外有28个电子,镍原子3d、4s能级上电子为其价电子,根据构造原理书写其价电子排布式;
②利用均摊法计算该晶胞中氢气分子和La原子个数之比,根据氢分子和La原子个数的关系式计算;
(2)①同周期自左而右元素电负性增大,元素的非金属性越强其电负性越强;
②同周期自左而右元素第一电离能呈增大趋势,N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,非金属性越强第一电离能越大,故N元素的第一电离能最大;
③对硝基苯酚水合物之间氧原子和氢原子间存在氢键;
(3)原子个数相等价电子数相等的微粒属于等电子体,且等电子体结构相似,阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构,则该离子是NO4 3-,根据价层电子对互斥理论确定其杂化方式.
②利用均摊法计算该晶胞中氢气分子和La原子个数之比,根据氢分子和La原子个数的关系式计算;
(2)①同周期自左而右元素电负性增大,元素的非金属性越强其电负性越强;
②同周期自左而右元素第一电离能呈增大趋势,N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,非金属性越强第一电离能越大,故N元素的第一电离能最大;
③对硝基苯酚水合物之间氧原子和氢原子间存在氢键;
(3)原子个数相等价电子数相等的微粒属于等电子体,且等电子体结构相似,阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构,则该离子是NO4 3-,根据价层电子对互斥理论确定其杂化方式.
解答:解:(1)①Ni是28号元素,其核外有28个电子,1s22s22p63s23p63d84s2,镍原子3d、4s能级上电子为其价电子,Ni原子的价电子排布式为3d84s2,故答案为:3d84s2;
②该晶胞中氢气分子个数=8×
,La原子个数=8×
=1,所以该物质中氢分子和La原子个数比是3:1,则含1mol La的合金可吸附H2的数目为,故答案为:3NA;
(2)①元素的非金属性越强其电负性越强,O、N、C、H的非金属性逐渐减弱,所以O、N、C、H的电负性逐渐减弱,则O、N、C、H的电负性由大到小的顺序是O>N>C>H,故答案为:O>N>C>H;
②同周期自左而右元素第一电离能呈增大趋势,N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,非金属性越强第一电离能越大,故N元素的第一电离能最大,其原子的轨道表示式为: ,故答案为:
,故答案为: ;
;
③对硝基苯酚水合物之间氧原子和氢原子间存在氢键,所以对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是氢键,故答案为:氢键;
(3)原子个数相等价电子数相等的微粒属于等电子体,且等电子体结构相似,阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构,则该离子是NO4 3-,其电子式为: ,该离子中价层电子对数为4,所以N原子采用sp3杂化,
,该离子中价层电子对数为4,所以N原子采用sp3杂化,
故答案为: ,sp3.
,sp3.
②该晶胞中氢气分子个数=8×
| 1 |
| 8 |
| 1 |
| 8 |
(2)①元素的非金属性越强其电负性越强,O、N、C、H的非金属性逐渐减弱,所以O、N、C、H的电负性逐渐减弱,则O、N、C、H的电负性由大到小的顺序是O>N>C>H,故答案为:O>N>C>H;
②同周期自左而右元素第一电离能呈增大趋势,N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,非金属性越强第一电离能越大,故N元素的第一电离能最大,其原子的轨道表示式为:
 ,故答案为:
,故答案为: ;
;③对硝基苯酚水合物之间氧原子和氢原子间存在氢键,所以对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是氢键,故答案为:氢键;
(3)原子个数相等价电子数相等的微粒属于等电子体,且等电子体结构相似,阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构,则该离子是NO4 3-,其电子式为:
 ,该离子中价层电子对数为4,所以N原子采用sp3杂化,
,该离子中价层电子对数为4,所以N原子采用sp3杂化,故答案为:
 ,sp3.
,sp3.点评:本题是物质结构与性质的综合题目,涉及杂化轨道、电离能、电负性、核外电子排布规律、晶胞计算等,难度中等,难点是NO4 3-电子式的书写,正确理解“该阴离子中的各原子的最外层电子都满足8电子稳定结构”是解(3)题的关键,需要学生全面掌握基础知识,难度中等.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
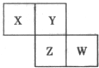 (2012?唐山二模)X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
(2012?唐山二模)X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )