摘要:阳离子与阴离子的半径比为 (2)氯化钠晶体中两个距离最近的钠离子的核间距约为 .(已知氯化钠的式量为58.5.密度为2.2g/cm-3,阿伏加德罗常数为6.02× 1023 mol-)
网址:http://m.1010jiajiao.com/timu3_id_267422[举报]
在离子晶体中,阴、阳离子按一定规律在空间排列,如图左图所示为NaCl的晶体结构图。在离子晶体中,阴、阳离子具有或接近具有球对称的电子云,它们可以被看成是不等径的刚性圆球,并彼此相切(如图所示)。离子键的键长是相邻阴、阳离子的半径之和,已知a为常数。

试回答下列问题。
(1)在NaCl晶体中,每个Na+同时吸引_____个Cl-,而Na+数目与Cl-数目之比为_____。
(2)NaCl晶体离子键的键长为_____。
(3)Na+半径与Cl-半径之比r(Na+)/r(Cl-)=_______。
(已知: = 1.414,
= 1.414,  =1.732,
=1.732, 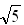 =2.236)
=2.236)
(4)NaCl中晶体不存在分子,但在温度达到1 413℃时,NaCl晶体形成气体,并以分子形式存在。现有29.25g NaCl晶体,加强热使温度达到1 450℃,测得气体体积为5.6 L(已折算为标准状况),则此时氯化钠气体的分子式(化学式)为__________。
查看习题详情和答案>>
(1)在NaCl晶体中,每个Na+同时吸引_____个Cl-,而Na+数目与Cl-数目之比为_____。
(2)NaCl晶体离子键的键长为_____。
(3)Na+半径与Cl-半径之比r(Na+)/r(Cl-)=_______。
(已知:
 = 1.414,
= 1.414,  =1.732,
=1.732, 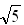 =2.236)
=2.236) (4)NaCl中晶体不存在分子,但在温度达到1 413℃时,NaCl晶体形成气体,并以分子形式存在。现有29.25g NaCl晶体,加强热使温度达到1 450℃,测得气体体积为5.6 L(已折算为标准状况),则此时氯化钠气体的分子式(化学式)为__________。
(2004·烟台)在离子晶体中,阴、阳离子按一定规律在空间排列,下图A是NaCl的晶体结构,在离子晶体中,阴、阳离子具有或近似具有球形对称结构,它们可以被看作是不等径的刚性圆球,并彼此相切如NaCl晶体结构如图B,已知a为常数.

(1)在NaCl晶体中,每个 同时吸引_______个
同时吸引_______个 ;而
;而 数目和
数目和 数目之比为_______.
数目之比为_______.
(2) 半径与
半径与 半径之比
半径之比 =______________(已知
=______________(已知 ).
).
(3)NaCl晶体中不存在分子,但在 ,1 413℃时,NaCl晶体形成气体,并以分子形式存在.现有29.25g NaCl晶体,在
,1 413℃时,NaCl晶体形成气体,并以分子形式存在.现有29.25g NaCl晶体,在 时强热使温度达到1 501.5℃,测得气体体积为36.4L,试应用有关物理、化学知识计算此时氯化钠气体的分子式(化学式)为______(不写计算过程).
时强热使温度达到1 501.5℃,测得气体体积为36.4L,试应用有关物理、化学知识计算此时氯化钠气体的分子式(化学式)为______(不写计算过程).
(4)若 ,求NaCl晶体的密度(已知
,求NaCl晶体的密度(已知 ,NaCl的摩尔质量为
,NaCl的摩尔质量为 ).
).
一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:
NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s).
(1)上述反应涉及的第三周期元素中,离子半径最小的是 (用元素符号表示).Cl原子与Si原子可以形成的五核分子,其化学键长和键角都相等,则该物质为 分子(填“极性”或“非极性”).
(2)表示原子或离子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式.从中选择最详尽描述核外电子运动状态的方式,来表示氧离子核外电子的运动状态: .
(3)上述元素的最高价氧化物对应水化物中,既能与强酸又能与强碱反应,其原因在于: (用电离方程式表示).
(4)Al与Cl可以形成分子晶体AlCl3,关于AlCl3溶液的说法错误的是 .
A.水溶液中离子浓度大小:c(Cl-)>c(Al3+)>c(H+)>c(OH-)
B.升高温度,AlCl3水溶液pH减小,c(Al3+)减小
C.c(Al3+)+c(H+)=c(Cl-)+c(OH-)
D.c(Cl-)=3c(Al3+)+3c(AlO2-)
(5)不能用于比较Na与Al金属性相对强弱的事实是 .
A.最高价氧化物对应水化物的碱性 B.Na和AlCl3溶液反应
C.单质与H2O反应的难易程度 D.比较同浓度NaCl和AlCl3的pH值
(6)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为 .用电子式表示Na2O2的形成过程: .
查看习题详情和答案>>
NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s).
(1)上述反应涉及的第三周期元素中,离子半径最小的是
(2)表示原子或离子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式.从中选择最详尽描述核外电子运动状态的方式,来表示氧离子核外电子的运动状态:
(3)上述元素的最高价氧化物对应水化物中,既能与强酸又能与强碱反应,其原因在于:
(4)Al与Cl可以形成分子晶体AlCl3,关于AlCl3溶液的说法错误的是
A.水溶液中离子浓度大小:c(Cl-)>c(Al3+)>c(H+)>c(OH-)
B.升高温度,AlCl3水溶液pH减小,c(Al3+)减小
C.c(Al3+)+c(H+)=c(Cl-)+c(OH-)
D.c(Cl-)=3c(Al3+)+3c(AlO2-)
(5)不能用于比较Na与Al金属性相对强弱的事实是
A.最高价氧化物对应水化物的碱性 B.Na和AlCl3溶液反应
C.单质与H2O反应的难易程度 D.比较同浓度NaCl和AlCl3的pH值
(6)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为
(2010?扬州模拟)工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高.
(1)基态钛原子的核外电子排布式为
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于
(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.下列说法正确的是
A.SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42-稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为
(6)在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为
查看习题详情和答案>>
(1)基态钛原子的核外电子排布式为
[Ar]3d24s2
[Ar]3d24s2
.(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于
分子
分子
晶体.(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.下列说法正确的是
B
B
.A.SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42-稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是
MgO
MgO
,原因是均为离子晶体,而Mg2+与O2-半径和小于K+与Cl-半径和且MgO中阴阳离子所带电荷均比KCl中阴阳离子所带电荷多,故MgO晶格能比KCl大,熔点高
均为离子晶体,而Mg2+与O2-半径和小于K+与Cl-半径和且MgO中阴阳离子所带电荷均比KCl中阴阳离子所带电荷多,故MgO晶格能比KCl大,熔点高
.(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为
sp3
sp3
,分子的空间构型为V形(折线形)
V形(折线形)
.(6)在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为
2:3
2:3
.
图(1)是NaCl的晶体结构。在NaCl的晶体结构中,钠离子和氯离子可以被看成是不等径的刚性网球,并彼此相切如图(2)。离子键的键长是相邻阴、阳离子的半径之和如图(3),已知a为常数。

试回答下列问题:
(1)在NaCl晶体中,每个Na+同时吸引_______个Cl-,Na+数目与C1-数目之比为_____。
(2)Na+半径与Cl-半径之比为r+:r-=_______(已知 = 1.414,=1.732,=2.236)。
(3)NaCI晶体不存在分子,但在温度达到l 413℃时,NaCl晶体形成气体,并以分子形式存在,现有29.25 g NaCl晶体,强热使温度达到1450℃,测得气体体积为5.6 L (已折算为标准状况),则此时氯化钠气体的分子式为________。
查看习题详情和答案>>
(1)在NaCl晶体中,每个Na+同时吸引_______个Cl-,Na+数目与C1-数目之比为_____。
(2)Na+半径与Cl-半径之比为r+:r-=_______(已知 = 1.414,=1.732,=2.236)。
(3)NaCI晶体不存在分子,但在温度达到l 413℃时,NaCl晶体形成气体,并以分子形式存在,现有29.25 g NaCl晶体,强热使温度达到1450℃,测得气体体积为5.6 L (已折算为标准状况),则此时氯化钠气体的分子式为________。