摘要:1.在450C密闭容器中进行下列反应:2SO2(g)+O2(g) 2SO3(g).若起始时c(SO2)=0.010mol/L.c(O2)=0.02mol/L.10s后气体压强为起始时的95%.则该反应的平均反应速率是 A.v(O2)=1.5×10-3 mol·L-1·s-1 B.v(O2)=1.5×10-4mol·L-1·s-1 C.v(SO2)=3.0×10-3 mol·L-1·s-1 D.v(SO3)=3.0×10-5 mol·L-1·s-1
网址:http://m.1010jiajiao.com/timu3_id_266067[举报]
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少N的氧化物在大气中的排放是环境保护的重要内容之一.
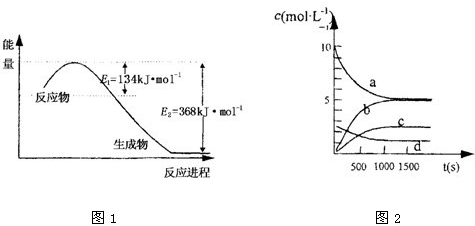
(1)图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图1,请写出NO2和CO反应的热化学方程式
又知:N2 (g)+O2 (g)=2NO(g)△H=+180kJ?mol-1;2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ?mol-1;则反应:2NO(g)+2CO2(g)?N2(g)+2CO2(g)的△H=
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2 (g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
①写出该反应的平衡常数表达式:K=
,已知:K300℃>K350℃,则该反应是
②反应达到平衡后,NO2的转化率为
③如图2中表示N2O5 的浓度的变化曲线是
查看习题详情和答案>>

(1)图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图1,请写出NO2和CO反应的热化学方程式
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
;又知:N2 (g)+O2 (g)=2NO(g)△H=+180kJ?mol-1;2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ?mol-1;则反应:2NO(g)+2CO2(g)?N2(g)+2CO2(g)的△H=
-760.3kJ?mol-1
-760.3kJ?mol-1
;(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2 (g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
| c2(N2O5) |
| c4( NO2)c(O2) |
| c2(N2O5) |
| c4( NO2)c(O2) |
放
放
热反应②反应达到平衡后,NO2的转化率为
49.6%
49.6%
,此时若再通入一定量氮气,则NO2的转化率将不变
不变
(填“增大”、“减小”、“不变”);③如图2中表示N2O5 的浓度的变化曲线是
c
c
,用O2表示从0~500s内该反应的平均速率v=1.51×10-3mol/(L?s)
1.51×10-3mol/(L?s)
.在一定条件下,在2L密闭容器中发生反应3A(g)+B(g)═2C(g),开始时加入4mol A、6mol B、2mol C,在2min末时测得C的物质的量是3mol.
(1)用A的浓度变化表示反应的平均速率为v(A)=
(2)2min末时,B的浓度为c(B)=
查看习题详情和答案>>
(1)用A的浓度变化表示反应的平均速率为v(A)=
0.375 mol/(L?min).
0.375 mol/(L?min).
;(2)2min末时,B的浓度为c(B)=
2.75 mol/L.
2.75 mol/L.
.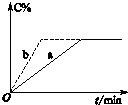 一定条件下,在一密闭容器中,发生可逆反应:2A(g)+B(g)?3C(g)△H>0,
一定条件下,在一密闭容器中,发生可逆反应:2A(g)+B(g)?3C(g)△H>0,C的体积分数变化如图实线a所示,若开始只改变某一条件,C的体积分数如
图虚线b所示,则下列说法不正确的是( )
| A、所改变的条件可能是加入催化剂 | B、所改变的条件可能是升高温度 | C、所改变的条件可能是加压 | D、a、b两个过程的热效应可能相同 |
氮气与氢气反应生成氨气的平衡常数见表:
(1)工业上合成氨的温度一般控制在500℃,原因是 .
(2)在2L密闭容器中加入1mol氮气和3mol氢气,进行工业合成氨的模拟实验,若2分钟后,容器内压强为原来的0.8倍,则0到2分钟,氨气的反应速率为 mol/(L?min).
(3)下列说法能表明该反应达到平衡的是 .
A.气体的平均分子量不再变化
B.密闭容器内的压强不再变化
C.v(N2)=2v(NH3)
D.气体的密度不再变化
(4)下列措施,既能加快该反应的反应速率,又能增大转化率的是 .
A.使用催化剂 B.缩小容器体积 C.提高反应温度 D.移走NH3
(5)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是 .
A.溶液的pH增大 B.氨水的电离度减小 C.(OH-)减小 D.(NH4+)减小
(6)将氨水与盐酸等浓度等体积混合,下列做法能使(NH4+)与(Cl-)比值变大的是 .
A.加入固体氯化铵 B.通入少量氯化氢 C.降低溶液温度 D.加入少量固体氢氧化钠.
查看习题详情和答案>>
| N2+3H2?2NH3 | ||||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
(2)在2L密闭容器中加入1mol氮气和3mol氢气,进行工业合成氨的模拟实验,若2分钟后,容器内压强为原来的0.8倍,则0到2分钟,氨气的反应速率为
(3)下列说法能表明该反应达到平衡的是
A.气体的平均分子量不再变化
B.密闭容器内的压强不再变化
C.v(N2)=2v(NH3)
D.气体的密度不再变化
(4)下列措施,既能加快该反应的反应速率,又能增大转化率的是
A.使用催化剂 B.缩小容器体积 C.提高反应温度 D.移走NH3
(5)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是
A.溶液的pH增大 B.氨水的电离度减小 C.(OH-)减小 D.(NH4+)减小
(6)将氨水与盐酸等浓度等体积混合,下列做法能使(NH4+)与(Cl-)比值变大的是
A.加入固体氯化铵 B.通入少量氯化氢 C.降低溶液温度 D.加入少量固体氢氧化钠.