题目内容
在一定条件下,在2L密闭容器中发生反应3A(g)+B(g)═2C(g),开始时加入4mol A、6mol B、2mol C,在2min末时测得C的物质的量是3mol.
(1)用A的浓度变化表示反应的平均速率为v(A)=
(2)2min末时,B的浓度为c(B)=
(1)用A的浓度变化表示反应的平均速率为v(A)=
0.375 mol/(L?min).
0.375 mol/(L?min).
;(2)2min末时,B的浓度为c(B)=
2.75 mol/L.
2.75 mol/L.
.分析:(1)根据v=
计算v(A);
(2)计算出B的浓度变化,初始浓度-变化浓度=2min末的浓度.
| △c |
| △t |
(2)计算出B的浓度变化,初始浓度-变化浓度=2min末的浓度.
解答:解:利用三段式计算:3A(g)+B(g)═2C(g),
开始 4mol 6mol 2mol
变化 1.5mol 0.5mol 1mol
2min末 2.5mol 5.5mol 3mol
(1)2min内,用A表示平均速率为 v(A)=
=
=0.375 mol/(L?min),
故答案为:0.375 mol/(L?min).
(2)2min内,B的浓度变化为△(B)=
=0.25mol/L,
2min末b的浓度为
-0.25mol/L=2.75 mol/L.
故答案为:2.75 mol/L.
开始 4mol 6mol 2mol
变化 1.5mol 0.5mol 1mol
2min末 2.5mol 5.5mol 3mol
(1)2min内,用A表示平均速率为 v(A)=
| △(A) |
| △t |
| ||
| 2min |
故答案为:0.375 mol/(L?min).
(2)2min内,B的浓度变化为△(B)=
| △n(B) |
| V |
| 0.5mol |
| 2L |
2min末b的浓度为
| 6mol |
| 2L |
故答案为:2.75 mol/L.
点评:考查化学反应速率的计算,难度不大,注意对基础知识的理解、积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
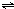 ClO(g)+3H2(g)△H>0.
ClO(g)+3H2(g)△H>0.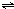 CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
 2SO3(g),进行到4min时,测得n(SO2)=0.4mol,若反应进行到2min时,容器中n(SO2)为
2SO3(g),进行到4min时,测得n(SO2)=0.4mol,若反应进行到2min时,容器中n(SO2)为