网址:http://m.1010jiajiao.com/timu3_id_264414[举报]
(1)有学者提出利用Fe2+、Fe3+等离子的催化作用,常温下将SO2氧化成SO
2- 4 |
2- 4 |
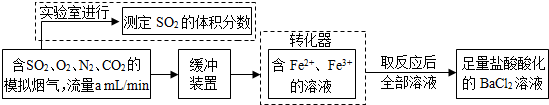
①该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号)

A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液
②若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成
2- 4 |
(2)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品.该技术的优点是
(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2.该方法涉及到的化学反应为:SO2+2CO=2CO2+
| 1 |
| x |
| 1 |
| x |
| 3 |
| x |
(4)若生活污水中含大量的含氮化合物,通常用生物膜脱氮工艺进行处理:首先在细菌的作用下将NH
+ 4 |
- 3 |
+ 4 |
- 3 |
- 3 |
Al2O3+3C+N2
| 高温 |
(问题探究)某化学研究性学习小组成员根据氮化铝的制取原理,进行了如下探究.
问题1、在制取氮化铝时由于反应不完全,氮化铝产品中所含杂质除了碳以外还可能存在
问题2、为测定该产品中有关成分的含量,甲、乙两同学设计了以下两个实验:
(1)甲同学:称取10.00g样品,将其加入过量的氢氧化钠溶液中共热并蒸干,AlN跟氢氧化钠溶液反应生成NaAlO2,并放出氨气3.36L(标准状况).
①上述反应的化学方程式为
②该样品中的AlN的质量分数为
(2)乙同学:称取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g?L-1(已折成标准状况,AlN不跟O2反应).该样品中含杂质碳
问题3、丙同学受到甲、乙同学实验的启发,认为测定某氮化铝中含有碳或氧化铝杂质,可用图中I的一些装置来进行检验,根据AlN与NaOH溶液反应所生成氨气的体积来测定样品中氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)
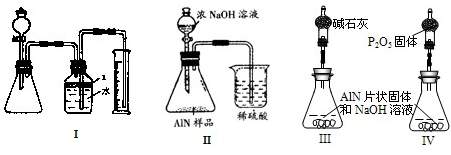
(1)实验有关操作为:①往锥形瓶中放入适量的AlN样品:②从分液漏斗往锥形瓶中加入过量的浓NaOH;③检验装置的气密性;④测定收集到水的体积.
正确的操作顺序为
(2)本试验中检查装置气密性的方法是
(3)广口瓶中的试剂X可最好选用
A、苯 B、酒精 C、植物油 D、CCl4
(4)广口瓶的液体没有装满(上方留有少量空间),实验测得NH3的体积将
(5)若实验中测得样品的质量为wg,氨气的体积为aL(标况下),则样品中AlN的质量分数为
| 4100a |
| 22.4w |
| 4100a |
| 22.4w |
(6)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是
问题4、丁同学认为,丙同学的实验方法,可能因气体体积测量不准,导致误差较大.建议改用图9中的Ⅱ装置进行同样实验,通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数.你认为是否可行?
问题5、戊同学仔细思考了丁同学的装置后,认为此装置所测测得的样品中AlN含量偏小.其原因是
(1)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下:
(Ⅰ)将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液.
(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸.
(Ⅲ)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用.
①写出步骤(Ⅰ)反应的化学方程式:
②写出步骤(Ⅲ)反应的离子方程式:
(2)还有学者提出利用 Fe2+、Fe3+等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用.某研究性学习小组据此设计了如下1方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率.
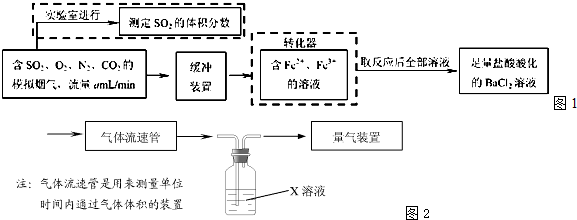
①该小组采用图2装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号)
A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液
②若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是
(3)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品.该技术的优点是
(4)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2.该方法涉及到的化学反应为:SO2+2CO=2CO2+
| 1 |
| x |
| 1 |
| x |
| 3 |
| x |
(5)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体.请写出加入甲醇后反应的离子方程式
(13分)近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式:
② 写出步骤(III)反应的离子方程式:
⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。
① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) 。(参考:还原性SO2 > I- >Br->Cl-)
A.碘的淀粉溶液 B.酸性高锰酸钾溶液
C.氢氧化钠溶液 D.氯化钡溶液
② 若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是 和加入盐酸酸化的氯化钡溶液后生成沉淀的质量。
(3) 新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品。该技术的优点是 。
(4) 为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+Sx 、
CO+Sx=COS、2COS+SO2=2CO2+
Sx 。其中COS中“C”化合价为 。
(5)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将
NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇【CH3OH】,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
查看习题详情和答案>>
(13分)近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式:
② 写出步骤(III)反应的离子方程式:
⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。
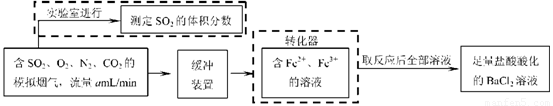
① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) 。(参考:还原性SO2 > I- >Br->Cl-)
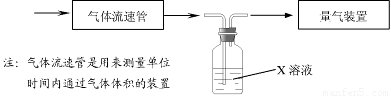
A.碘的淀粉溶液 B.酸性高锰酸钾溶液
C.氢氧化钠溶液 D.氯化钡溶液
② 若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是 和加入盐酸酸化的氯化钡溶液后生成沉淀的质量。
(3) 新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品。该技术的优点是 。
(4) 为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+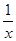 Sx 、
Sx 、
CO+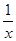 Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+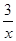 Sx 。其中COS中“C”化合价为 。
Sx 。其中COS中“C”化合价为 。
(5)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将
NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇【CH3OH】,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
查看习题详情和答案>>