网址:http://m.1010jiajiao.com/timu3_id_259216[举报]
 (1)材料是人类赖以生存和发展的重要物质基础.
(1)材料是人类赖以生存和发展的重要物质基础.①住宅建设需要大量的建筑材料.下列物质不属于硅酸盐材料的是
a.水泥 b.石灰石 c.玻璃
②现代生活离不开金属材料.下列钢铁的防腐方法中,防腐效果最好,
但相对费用也最贵的是
a.刷点油漆 b.包塑料层(镀塑) c.涂点油脂
③塑料应用于生产、生活各个领域.聚乙烯塑料属于
a.有机高分子材料 b.无机非金属材料 c.金属材料
(2)2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视.
①汽车上加装尾气催化净化装置(如图1),可以使NO、CO相互反应转化为CO2和一种单质的物质为
②明矾可用作废水处理的混凝剂,Al3+水解生成的
③煤燃烧产生的SO2所形成的酸雨中,SO2最终转化成的酸是
(3)某种食品的配料标签如图2所示.
①该配料中,富含蛋白质的物质是
②该配料中的
| ||
| ||
③淀粉水解液中有淀粉未水解的检验通常是滴加碘水,出现的现象是:
请回答下列问题:
(1)生成的黑色物质(单质)是
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是
| ||
| ||
(3)根据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有
A.酸性
B.吸水性
C.脱水性
D.强氧化性
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液
(5)能否用澄清石灰水鉴别这两种气体?
(12分)高锰酸钾是深紫色的针状晶体,是最重要也是最常用的氧化剂之一,可用来漂白棉、毛、丝等纺织品。已知温度高于80℃高锰酸钾会部分分解
实验室以软锰矿(主要成份是MnO2)为主要原料来制备高锰酸钾,分两步进行:
第一步是将+4价的锰氧化成为+6价,反应方程式为:
![]()
第二步是在通入CO2条件下使+6价的锰歧化为+7价和+4价(MnO2)。
实验流程如下: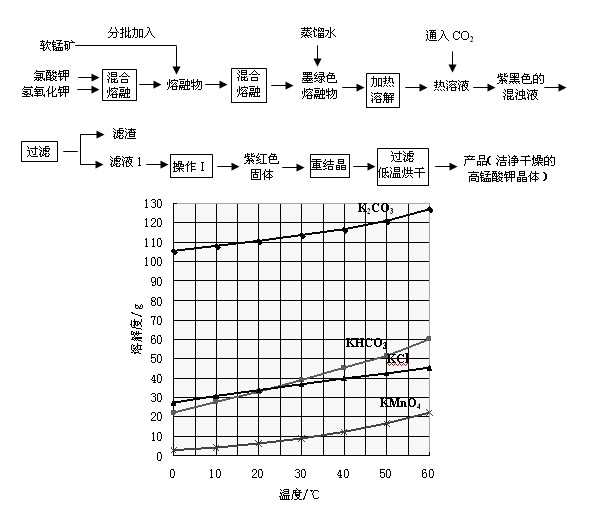
几种物质的溶解度随温度变化如上图所示。回答下列问题:
(1)下列仪器中,混合熔融氯酸钾和氢氧化钾固体过程中需要用到的是
A.蒸发皿 B.玻璃棒 C.铁棒 D.坩埚 E.泥三角 F.烧杯 G.酒精灯 H.铁坩埚
![]()
(2)通入适量二氧化碳,锰酸钾发生岐化反应的化学方程式是
![]()
(3)通入适量的二氧化碳直到锰酸钾全部岐化为止(可用玻璃棒蘸取溶液点于滤纸上,如果滤纸上只有紫红色而无绿色
痕迹,即表示锰酸钾已歧化完全),二氧化碳的通入量不能过多的原因是 。
![]()
(4)操作Ⅰ应该在 (填“加压”、“减压”、“常压”)情况下蒸发,其理由是 。(5)除了酸化可以使锰酸钾发生岐化反应生成高锰酸钾外(歧化法),通过使用惰性电极电解锰酸钾溶液也可以制备高锰酸钾。电解时阴极有气泡产生,则阳极的电极反为 。
与歧化法相比,电解法主要的优点是 。
查看习题详情和答案>>(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体.C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是:
| ||
| ||
a.BaCl2溶液 b.KMnO4溶液 c.品红溶液 d.酸化的Ba(NO3)2溶液
向500mL2mol/L的NaOH溶液中通入0.8mol无色无味的C气体,恰好完全反应,该反应的化学方程式是
(2)若A为红色金属单质,与适量B的溶液在常温下恰好完全反应,生成的无色气体C遇空气迅速变成经棕色.若被还原的B物质的量为2mol时,产生C气体的体积是
(3)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;D是漂白粉的成分之一.C发生水解反应的离子方程式是
(4)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体.检验A中阴离子的方法是
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成.
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水成分搅拌、过滤.
(1)往滤渣中加入过量NaOH溶液,过滤.氢氧化铝与NaOH溶液反应的离子方程式是
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸,观察到的现象是
Ⅱ.牙膏样品中碳酸钙的定量测定
利用如下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.

依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气.其作用除了可搅拌B、C中的反应物外,还有:
(4)C中反应生成BaCO3的化学方程式是
(5)下列各项措施中,不能提高测定准确度的是
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g.则样品中碳酸钙的质量分数为
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数.实验证明按此方法测定的结果明显偏高,原因是