网址:http://m.1010jiajiao.com/timu3_id_258119[举报]
(1)用甲烷制氢是一种廉价的制氢方法。有关的热化学方程式如下:
CH4(g)+1/2O2(g)
 CO(g)+2H2(g);△H= -36kJ/mol……… ①
CO(g)+2H2(g);△H= -36kJ/mol……… ①
CH4(g)+H2O(g)
 CO(g)+3H2(g);△H= +216kJ/mol…………②
CO(g)+3H2(g);△H= +216kJ/mol…………②
①下列说法正确的是 ____
A.2H2O(l)=2H2(g)+O2(g) △H=+504kJ/mol
B.当反应①中υ(CH4)正=υ(CO)正时,表明该反应达平衡状态
C.其它条件不变时,增大体系压强,反应①②中甲烷的转化率均增大
D.为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,消耗甲
烷的物质的量之比为6∶1
②某温度下,在100L反应器中充入甲烷和水蒸汽的物质的量分别为100mol和300mol时,假定只发生反应CH4(g)+H2O(g)  CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为 _______
CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为 _______
(2)发蓝液是由NaNO3、NaNO2及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的Fe3O4:
3Fe+NaNO2+5NaOH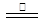 3Na2FeO2+H2O+NH3↑…………①;
3Na2FeO2+H2O+NH3↑…………①;
8Fe+3NaNO3+5NaOH+2H2O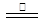 4Na2Fe2O4+3NH3↑……②;
4Na2Fe2O4+3NH3↑……②;
以及第三步生成四氧化三铁。请补充第三步反应的方程式并配平: __________________
查看习题详情和答案>>
(1)用甲烷制氢是一种廉价的制氢方法。有关的热化学方程式如下:
CH4(g)+1/2O2(g)  CO(g)+2H2(g);△H= -36kJ/mol……… ①
CO(g)+2H2(g);△H= -36kJ/mol……… ①
CH4(g)+H2O(g)  CO(g)+3H2(g);△H= +216kJ/mol…………②
CO(g)+3H2(g);△H= +216kJ/mol…………②
①下列说法正确的是 ____
| A.2H2O(l)=2H2(g)+O2(g) △H=+504kJ/mol |
| B.当反应①中υ(CH4)正=υ(CO)正时,表明该反应达平衡状态 |
| C.其它条件不变时,增大体系压强,反应①②中甲烷的转化率均增大 |
| D.为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,消耗甲 |
②某温度下,在100L反应器中充入甲烷和水蒸汽的物质的量分别为100mol和300mol时,假定只发生反应CH4(g)+H2O(g)
 CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为 _______
CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为 _______(2)发蓝液是由NaNO3、NaNO2及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的Fe3O4:
3Fe+NaNO2+5NaOH
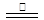 3Na2FeO2+H2O+NH3↑…………①;
3Na2FeO2+H2O+NH3↑…………①;8Fe+3NaNO3+5NaOH+2H2O
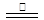 4Na2Fe2O4+3NH3↑……②;
4Na2Fe2O4+3NH3↑……②;以及第三步生成四氧化三铁。请补充第三步反应的方程式并配平: __________________ 查看习题详情和答案>>
CH4(g)+1/2O2(g)
 CO(g)+2H2(g);△H= -36kJ/mol……… ①
CO(g)+2H2(g);△H= -36kJ/mol……… ①CH4(g)+H2O(g)
 CO(g)+3H2(g);△H= +216kJ/mol…………②
CO(g)+3H2(g);△H= +216kJ/mol…………②①下列说法正确的是 ____
| A.2H2O(l)=2H2(g)+O2(g) △H=+504kJ/mol |
| B.当反应①中υ(CH4)正=υ(CO)正时,表明该反应达平衡状态 |
| C.其它条件不变时,增大体系压强,反应①②中甲烷的转化率均增大 |
| D.为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,消耗甲 |
②某温度下,在100L反应器中充入甲烷和水蒸汽的物质的量分别为100mol和300mol时,假定只发生反应CH4(g)+H2O(g)
 CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为 _______
CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为 _______(2)发蓝液是由NaNO3、NaNO2及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的Fe3O4:
3Fe+NaNO2+5NaOH
 3Na2FeO2+H2O+NH3↑…………①;
3Na2FeO2+H2O+NH3↑…………①;8Fe+3NaNO3+5NaOH+2H2O
 4Na2Fe2O4+3NH3↑……②;
4Na2Fe2O4+3NH3↑……②;以及第三步生成四氧化三铁。请补充第三步反应的方程式并配平: __________________
|
管道煤气的主要成分是CO、H2( 体积比1∶1)和极少量甲烷,相应的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=-571.6 kJ·mol-12CO(g)+O2(g)=2CO2(g);△H=-566 kJ·mol-1 CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.3 kJ·mol-1 下列说法正确的是 | |
| [ ] | |
A. |
不能通过以上反应将化学能转化为电能 |
B. |
因为都是放热反应,所以不需要条件反应物一混合反应就能自动发生 |
C. |
等质量的 H2(g)和CO(g)完全燃烧放出的热量比大约是1∶1 |
D. |
当使用管道煤气的用户改烧天然气(主要成分为甲烷)后,在相同条件下燃烧等体积的燃气,理论上所获得的热量,后者大约是前者的3.1倍 |
2013年全国各地都遭遇“十面霾伏”。其中,机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是???????? (填代号)。
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)

(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)? △H=-867 kJ/mol
2NO2(g) N2O4(g)?? △H=-56.9 kJ/mol
N2O4(g)?? △H=-56.9 kJ/mol
H2O(g) = H2O(l)?? ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:???????????????????????????????????? 。
(3)用NH3催化还原NOX也可以消除氮氧化物的污染。如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),
反应原理为:NO(g) +NO2(g)+2NH3(g) 2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。

①该反应的△S???? 0,△H????? 0(填“>”、“=”或 “<”)。
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),
则上述反应的KP=???????????????? 。
③以下说法正确的是????????????????? 。
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为?? ??????????????????? ? 。

(5)硝酸工业尾气中氮氧化物(NO和NO2)可用尿素〔CO(NH2)2〕溶液除去。反应生成对大气无污染的气体。1 mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1:1)的质量为___________g。
查看习题详情和答案>>