题目内容
(1)用甲烷制氢是一种廉价的制氢方法。有关的热化学方程式如下:
CH4(g)+1/2O2(g)  CO(g)+2H2(g);△H= -36kJ/mol……… ①
CO(g)+2H2(g);△H= -36kJ/mol……… ①
CH4(g)+H2O(g)  CO(g)+3H2(g);△H= +216kJ/mol…………②
CO(g)+3H2(g);△H= +216kJ/mol…………②
①下列说法正确的是 ____
| A.2H2O(l)=2H2(g)+O2(g) △H=+504kJ/mol |
| B.当反应①中υ(CH4)正=υ(CO)正时,表明该反应达平衡状态 |
| C.其它条件不变时,增大体系压强,反应①②中甲烷的转化率均增大 |
| D.为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,消耗甲 |
②某温度下,在100L反应器中充入甲烷和水蒸汽的物质的量分别为100mol和300mol时,假定只发生反应CH4(g)+H2O(g)
 CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为 _______
CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为 _______(2)发蓝液是由NaNO3、NaNO2及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的Fe3O4:
3Fe+NaNO2+5NaOH
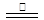 3Na2FeO2+H2O+NH3↑…………①;
3Na2FeO2+H2O+NH3↑…………①;8Fe+3NaNO3+5NaOH+2H2O
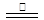 4Na2Fe2O4+3NH3↑……②;
4Na2Fe2O4+3NH3↑……②;以及第三步生成四氧化三铁。请补充第三步反应的方程式并配平: __________________
(1)①D ②1.35 (2)Na2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOH
解析试题分析:(1)①A.(② -①)×2可得2H2O(g)  O2(g)+2H2(g) △H= +504kJ/mol.错误.B. 对于反应①在何时刻都有υ(CH4)正=υ(CO)正,故不能表明该反应达平衡状态。错误。C.反应①②的正反应都是气体体积增大的反应。所以,其它条件不变时,增大体系压强,反应①②的平衡都是想逆反应方向移动。故二者中的甲烷的转化率均减小。错误。D.假设发生①的甲烷的物质的量为X,发生②的甲烷的物质的量为Y。为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,则36X=216Y。解得X:Y="6:1." 消耗甲烷的物质的量之比为6∶1。正确。选项为:D。②化学平衡常数K={C(CO)·C3(H2)}/{C(CH4)·C(H2O)}={0.5×1.53}{0.5×2.5}=1.35.(2)第三步反应的方程式为:Na2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOH
O2(g)+2H2(g) △H= +504kJ/mol.错误.B. 对于反应①在何时刻都有υ(CH4)正=υ(CO)正,故不能表明该反应达平衡状态。错误。C.反应①②的正反应都是气体体积增大的反应。所以,其它条件不变时,增大体系压强,反应①②的平衡都是想逆反应方向移动。故二者中的甲烷的转化率均减小。错误。D.假设发生①的甲烷的物质的量为X,发生②的甲烷的物质的量为Y。为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,则36X=216Y。解得X:Y="6:1." 消耗甲烷的物质的量之比为6∶1。正确。选项为:D。②化学平衡常数K={C(CO)·C3(H2)}/{C(CH4)·C(H2O)}={0.5×1.53}{0.5×2.5}=1.35.(2)第三步反应的方程式为:Na2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOH
考点:考查热化学方程式的书写、化学平衡状态的判断及钢铁的发蓝处理原理等知识。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
| A.Na2O2 + 2HCl =" 2NaCl" + H2O2 |
| B.Ag2O + H2O2 =" 2Ag" + O2↑ + H2O |
| C.2H2O2 = 2H2O + O2↑ |
| D.3H2O2 + Cr2(SO4)3 + 10KOH = 2K2CrO4 + 3K2SO4 + 8H2O |
(2)保存过氧化氢的试剂瓶上最适合贴上的一个标签是__________。

(3)某强酸性反应体系中,反应物和生成物共六种物质或离子:O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2↑。
①该反应的离子方程式是__________ 。
②如果上述反应中有2.24L(标准状况)气体生成,转移的电子的物质的量为__________mol。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN + H2O2 + H2O =" A" + NH3↑,试指出生成物A的化学式为__________,并阐明H2O2被称为“绿色氧化剂”的理由是_______________。
(5)请设计一个简单易行的实验证明过氧化氢具有氧化性。除过氧化氢外,供选择的试剂还有:氯水、稀硝酸、饱和硫化氢溶液。请将所选试剂和实验现象填入下表:
| 实验内容 | 试剂 | 实验现象 |
| 验证氧化性 | | |
水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是________(填字母编号,可多选)。
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含纯碱的废水 | 加石灰水反应 | 化学法 |
(2)下图是某市污水处理的工艺流程示意图:
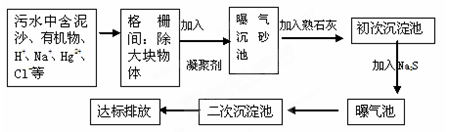
① 下列物质中不可以作为混凝剂(沉降剂)使用的是 (填字母编号,可多选)。
A.偏铝酸钠 B.氧化铝 C.碱式氯化铝 D.氯化铁
② 混凝剂除去悬浮物质的过程是 (填字母编号)。
A.只是物理过程 B. 只是化学过程 C. 是物理和化学过程
(3)在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:
KCN + 2KOH + Cl2 =" KOCN" + 2KCl + H2O 再投入过量液氯,可将氰酸盐进一步氯化为氮气。请配平下列化学方程式:口KOCN + 口KOH + 口Cl2→口CO2 + 口N2 + 口KCl + 口H2O若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯 g。
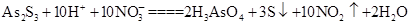 ,若生成2 mol H3AsO4,则反应中转移电子的物质的量为______。若将该反应设计成一原电池,则NO2应该在______(填“正极”或“负极”)附近逸出。
,若生成2 mol H3AsO4,则反应中转移电子的物质的量为______。若将该反应设计成一原电池,则NO2应该在______(填“正极”或“负极”)附近逸出。 Al(OH)3+N2+NaAlO2
Al(OH)3+N2+NaAlO2