网址:http://m.1010jiajiao.com/timu3_id_257923[举报]
用中和滴定法测定某烧碱的浓度.请回答在主要操作过程中的有关问题:
(1)将1.70 g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液.将0.20 mol/L的盐酸标准溶液装入酸式滴定管,滴定时,锥形瓶中加2-3滴________作为指示剂;滴定过程中,左手控制活塞,右手旋转摇动锥形瓶,眼睛应注视________,当________时即为滴定终点.有关数据如下:
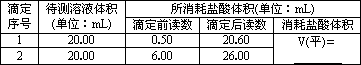
(2)计算:测得NaOH溶液的浓度为________mol/L,烧碱样品的纯度为________
(3)若该学生测定值偏大了,则引起测定误差的可能原因是________
A.酸式滴定管用水洗后,未用标准酸液润洗
B.酸式滴定管尖嘴部分有气泡未排除,滴定后气泡消失
C.锥形瓶用蒸馏水洗后,未用碱液洗
D.酸式滴定管起始读数俯视,滴定后读数仰视
E.在滴定过程中向锥形瓶中添加少量蒸馏水
F.取待测液时,碱式滴定管未用碱液洗
G.当指示剂局部变色时,停止滴定
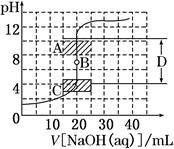
(1)为了准确绘制上图,在滴定开始时和________,滴液速度可以稍快一点,测试和记录pH的间隔可大些;当接近________时,滴液速度应该慢一些,尽量每滴一滴就测试一次。
(2)在图中A的pH范围使用的指示剂是____________;C的pH范围使用的指示剂是________________;D区域为________________。
(3)用0.1 032 mol·L-1的盐酸溶液滴定未知浓度的氢氧化钠溶液,重复三次的实验数据如下表所示:
| 实验序号 | 消耗0.1 032 mol·L-1的盐酸溶液的体积/mL | 待测氢氧化钠溶液的体积/mL |
| 1 | 28.84 | 25.00 |
| 2 | 27.83 | 25.00 |
| 3 | 27.85 | 25.00 |
则待测氢氧化钠的物质的量浓度是________mol·L-1。在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测定结果将________(填“偏高”、“偏低”或“不影响”)。
(4)下列关于上述中和滴定过程中的操作正确的是________(填字母)。
A.用碱式滴定管量取未知浓度的烧碱溶液
B.滴定管和锥形瓶都必须用待盛放液润洗
C.滴定中始终注视锥形瓶中溶液颜色变化
D.锥形瓶中的待测液可用量简量取
(17分)若用12 mol?L-1的浓盐酸配制0.10 mol?L-1的稀盐酸500 mL,回答下列问题:
(1)量取浓盐酸的体积为 mL,如果实验室有5mL、10mL、50mL量筒,应选用 mL量筒最好。若量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将 (偏高、偏低、无影响)。
(2)配制时应选用的容量瓶规格为 mL ,除容量瓶还需选用的仪器主要有 、 、 和 。
(3)配制时,将量取的浓盐酸沿烧杯内壁慢慢注入约100mL水里,并不断搅拌,目的是 。
(4)将冷却后的上述溶液沿 注入 中,并用约50mL蒸馏水洗涤烧杯2~3次,转移摇匀。(填仪器)
(5)加水至距刻度线  处,改用 (填仪器)滴加水,使溶液的凹液面正好跟刻度线相切,最后盖上瓶塞,摇匀。
处,改用 (填仪器)滴加水,使溶液的凹液面正好跟刻度线相切,最后盖上瓶塞,摇匀。
(6)若实验遇下列情况,溶液的浓度是偏高 ,偏低还是不变?
,偏低还是不变?
| A.加水时越过刻度线______ | B.忘记将洗涤液加入容量瓶______ |
C.容量瓶内壁附有水珠而未干燥处理 | D.溶解后没有冷却便进行定容 |
(1)量取浓盐酸的体积为 mL,如果实验室有5mL、10mL、50mL量筒,应选用 mL量筒最好。若量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将 (偏高、偏低、无影响)。
(2)配制时应选用的容量瓶规格为 mL ,除容量瓶还需选用的仪器主要有 、 、 和 。
(3)配制时,将量取的浓盐酸沿烧杯内壁慢慢注入约100mL水里,并不断搅拌,目的是 。
(4)将冷却后的上述溶液沿 注入 中,并用约50mL蒸馏水洗涤烧杯2~3次,转移摇匀。(填仪器)
(5)加水至距刻度线
 处,改用 (填仪器)滴加水,使溶液的凹液面正好跟刻度线相切,最后盖上瓶塞,摇匀。
处,改用 (填仪器)滴加水,使溶液的凹液面正好跟刻度线相切,最后盖上瓶塞,摇匀。(6)若实验遇下列情况,溶液的浓度是偏高
 ,偏低还是不变?
,偏低还是不变? | A.加水时越过刻度线______ | B.忘记将洗涤液加入容量瓶______ |
C.容量瓶内壁附有水珠而未干燥处理 | D.溶解后没有冷却便进行定容 |