摘要:3.28 14Si 元素位于周期表中 A.三周期IVA 族 B.二周期IVA 族 C.三周期VIA 族 D.二周期VIA 族
网址:http://m.1010jiajiao.com/timu3_id_257807[举报]
如图是元素周期表中的一部分.

在元素周期表中,同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强.请回答:
(1)硅的相对原子质量为
(2)原子半径:钠
查看习题详情和答案>>

在元素周期表中,同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强.请回答:
(1)硅的相对原子质量为
28.09
28.09
;原子序数为8的元素位于元素周期表的第2
2
周期,元素符号为O
O
,它属于非金属
非金属
(填“金属”或“非金属”)元素.(2)原子半径:钠
>
>
镁(填“>”或“=”或“<”,下同),原子得电子能力:硫<
<
氯.X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,且XZ2与Y2Z互为等电子体.含U的化合物的焰色为紫色.试回答下列问题:
(1)U单质的原子堆积方式为
(2)X的一种氢化物的相对分子质量为28,其分子中σ键与π键的键数之比为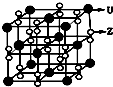
(3)化合物甲由Z、U两元素组成,其晶胞如右图所示.
①甲的化学式为
②下列有关该晶体的说法中正确的是
A.每个晶胞中含有14个U+和13个Z2-
B.晶体中每个U+周围距离U+最近的Z2-有6个
C.该晶体属于离子晶体
③甲的密度为a g?cm-3,则晶胞的体积是
cm3(只要求列出计算式,阿伏加德罗常数用NA表示).
查看习题详情和答案>>
(1)U单质的原子堆积方式为
体心立方堆积
体心立方堆积
,Y的简单氢化物分子式为NH3
NH3
.(2)X的一种氢化物的相对分子质量为28,其分子中σ键与π键的键数之比为
5:1
5:1
.
(3)化合物甲由Z、U两元素组成,其晶胞如右图所示.
①甲的化学式为
KO2
KO2
.②下列有关该晶体的说法中正确的是
BC
BC
(选填选项字母).A.每个晶胞中含有14个U+和13个Z2-
B.晶体中每个U+周围距离U+最近的Z2-有6个
C.该晶体属于离子晶体
③甲的密度为a g?cm-3,则晶胞的体积是
| 284 |
| aNA |
| 284 |
| aNA |
科学家发现具有2、8、20、28、50、82、114、126等数目的质子或中子的微粒具有特别的稳定性,并将这些偶数称为“幻数”,具有“双幻数”的:
He、
Ni、
Sn、
Pb等元素特别稳定.根据此信息判断下列说法中不正确的是( )
4 2 |
56 28 |
132 50 |
208 82 |
Ⅰ.A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.
已知:B原子有3个能级且各能级电子数相等;D原子最外能层P能级上有2个未成对电子,E是同周期元素中第一电离能最小的元素;F是同周期元素中原子半径最小的元素;A是非金属元素,且A、C、F可形成离子化合物.
请回答:
(1)A、D形成的三原子分子中心原子杂化类型是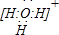
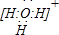 .
.
(2)元素A、D、F形成的原子数之比为1:1:1的化合物的电子式为
 ,其中心原子的杂化类型为
,其中心原子的杂化类型为
(3)请用电子式表示D、E原子个数比为1:1的化合物的形成过程

(4)在B原子与A形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称
Ⅱ.某合金由 X、Y、Z三种元素组成,这三种元素位于周期表中前四周期,X是主要成分元素,X的基态原子中有4个未成对电子.Y的含量不低于11%,否则不能生成致密氧化膜YO3防止腐蚀,Y与X同周期,且原子核外未成对电子数最多.Z位于周期表中第4行、第10列.
(5)请写出X、Y、Z的元素符号及原子序数X
(6)请写出Z的原子核外电子排布式
查看习题详情和答案>>
已知:B原子有3个能级且各能级电子数相等;D原子最外能层P能级上有2个未成对电子,E是同周期元素中第一电离能最小的元素;F是同周期元素中原子半径最小的元素;A是非金属元素,且A、C、F可形成离子化合物.
请回答:
(1)A、D形成的三原子分子中心原子杂化类型是
sp3
sp3
,分子空间构型为三角锥
三角锥
,其电子式为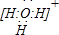
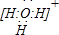
(2)元素A、D、F形成的原子数之比为1:1:1的化合物的电子式为


sp3
sp3
,VSEPR模型空间构型为四面体型
四面体型
.(3)请用电子式表示D、E原子个数比为1:1的化合物的形成过程


(4)在B原子与A形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称
丙烷
丙烷
,A、B、D元素的原子也可以共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式CO2+CO32-+H2O═2HCO3-
CO2+CO32-+H2O═2HCO3-
Ⅱ.某合金由 X、Y、Z三种元素组成,这三种元素位于周期表中前四周期,X是主要成分元素,X的基态原子中有4个未成对电子.Y的含量不低于11%,否则不能生成致密氧化膜YO3防止腐蚀,Y与X同周期,且原子核外未成对电子数最多.Z位于周期表中第4行、第10列.
(5)请写出X、Y、Z的元素符号及原子序数X
Fe、26
Fe、26
、YCr、24
Cr、24
ZNi、28
Ni、28
.(6)请写出Z的原子核外电子排布式
[Ar]3d84s2
[Ar]3d84s2
,X元素在周期表中的位置第四周期第Ⅷ族
第四周期第Ⅷ族
.(1)下表列出了a-f六种元素在周Fe2O3固体期表前三周期的位置.
请回答下列问题:
①c元素的名称是
②用元素符号表示,六种元素中,
③非金属性b
④用化学式表示,六种元素中,最高价氧化物属于两性氧化物的是
(2)①有机气体A是一种植物生长调节剂,其相对分子质量为28.A通入溴水中,能使溴水褪色.A的分子式是
②同分异构现象的广泛存在是造成有机物种类繁多的重要原因之一.C4H10有两种同分异构体,其结构简式分别是
查看习题详情和答案>>
| a | |||||||
| b | c | ||||||
| d | e | f | |||||
①c元素的名称是
氧
氧
,d元素位于第三周期第ⅠA
第三周期第ⅠA
族.②用元素符号表示,六种元素中,
He
He
元素的性质最稳定,Na
Na
元素的原子半径最大.③非金属性b
小于
小于
c.(填“大于”“小于”)④用化学式表示,六种元素中,最高价氧化物属于两性氧化物的是
Al(OH)3
Al(OH)3
,最高价氧化物对应水化物酸性最强的是HClO4
HClO4
.(2)①有机气体A是一种植物生长调节剂,其相对分子质量为28.A通入溴水中,能使溴水褪色.A的分子式是
C2H4
C2H4
,其与溴水反应的化学方程式是CH2=CH2+Br→CH2BrCH2Br
CH2=CH2+Br→CH2BrCH2Br
,反应类型为加成
加成
反应.②同分异构现象的广泛存在是造成有机物种类繁多的重要原因之一.C4H10有两种同分异构体,其结构简式分别是
CH3CH2CH2CH3
CH3CH2CH2CH3
,CH3CH(CH3)CH3
CH3CH(CH3)CH3
.