摘要:取代反应(X2.HNO3.H2SO4.) A.写出甲烷与Cl2在光照条件下的各步反应式. 在生成的卤代烃中.常温下呈气态的为 俗名为氯仿的是 常用作灭火剂的是 .由极性键构成的非极性分子为 .生成的产物中.其物质的量最多的是 . B.写出苯与溴在铁屑存在条件的反应式 思考:乙苯在铁屑存在下与溴作用生成的一卤代物有 种 C.写出制T.N.T反应式: 思考:比较苯.甲苯分别发生硝化反应的条件及其原因. 例1:若要使0.5mol甲烷完全和氯气发生取代反应.并且生成相同的物质的量的四种取代产物.则需要Cl2的物质的量为 A.0.5mol B.1.25mol C.2mol D.2.5mol
网址:http://m.1010jiajiao.com/timu3_id_251245[举报]
乙烯和苯是来自石油和煤的两种重要化工原料.请回答:
(1)乙烯通入溴的四氯化碳溶液中,观察到的现象是
 .
.
(2)乙烯大量用来生产环氧乙烷,生产工艺主要有两种:
工艺一:CH2=CH2+Cl2+Ca(OH)2→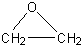 +CaCl2+H2O
+CaCl2+H2O
工艺二:2CH2=CH2+O2
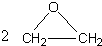
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,上述工艺一的原子利用率
(3)苯也是一种重要的化工原料,但人们对苯的认识经历了一个不断深化的过程.苯的分子式为
 ,称为凯库勒式,但后来大量实验事实和理论研究都表明,苯分子中6个碳原子之间的键是
,称为凯库勒式,但后来大量实验事实和理论研究都表明,苯分子中6个碳原子之间的键是
 .
.
查看习题详情和答案>>
(1)乙烯通入溴的四氯化碳溶液中,观察到的现象是
溶液褪色
溶液褪色
;其反应方程式为CH2=CH2+Br2→BrCH2CH2Br
CH2=CH2+Br2→BrCH2CH2Br
;乙烯在一定条件下发生加聚反应的化学方程式为

(2)乙烯大量用来生产环氧乙烷,生产工艺主要有两种:
工艺一:CH2=CH2+Cl2+Ca(OH)2→
 +CaCl2+H2O
+CaCl2+H2O工艺二:2CH2=CH2+O2
| Ag |

根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,上述工艺一的原子利用率
低
低
;工艺二的原子利用率为100%
100%
.因此,在实际生产中,应采用工艺二
二
更环保、更经济.(3)苯也是一种重要的化工原料,但人们对苯的认识经历了一个不断深化的过程.苯的分子式为
C6H6
C6H6
.由于苯与同碳原子数的己烷相比,高度缺氢,人们认为它是一种不饱和烃,1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,其结构式为

完全相同的
完全相同的
.因此用凯库勒式表示苯的结构式是不确切的,只是沿用至今而已.苯能发生取代反应,请写出苯与液溴发生取代反应的化学方程式

右图所示为一端封闭的U形管,封闭的一端有CH4
和Cl2的混合气体,U形管中的液体不参与反应。现使CH4
和Cl2的混合气体(体积比为1∶3充入)在可见光照射下缓
慢反应一段时间。
(1)写出甲烷与氯气发生一氯取代的反应方程式 。
(2)反应数小时后,U形管右侧(开放端)液体的液柱高度将 。
A.升高 B.下降 C.不变 D.难以确定
查看习题详情和答案>>(2010?漳州二模)[化学---有机化学基础]
香豆素是广泛存在于植物中的一类芳香族化合物,具有抗菌和消炎作用.它的核心结构是芳香内酯,其结构简式为 .
.
(1)下列关于芳香内酯的叙述正确的是
A.分子式为C9H8O2 B.可发生加聚反应
C.能与溴水发生反应 D.1mol芳香内酯最多能和5mol氢气发生加成反应
(2)写出芳香内酯在酸性条件下水解的化学方程式:
 .
.
(3)芳香内酯经下列步骤可转变为水杨酸等物质:

提示:CH3CH=CHCH2CH3
CH3COOH+CH3CH2COOH
请回答下列问题:
①指出D→F的反应类型为
②请写出反应C→E的化学方程式:
 .
.
③在一定条件下阿司匹林( )可由水杨酸制得.下列可检验阿司匹林样品中混有水杨酸的试剂是
)可由水杨酸制得.下列可检验阿司匹林样品中混有水杨酸的试剂是
a.三氯化铁溶液 b.碳酸氢钠溶液 c.石蕊试液 d.氢氧化钠溶液
④水杨酸的同分异构体中含有酚羟基且属于酯类的共有3种,写出其中一种同分异构体的结构简式
 .
.
查看习题详情和答案>>
香豆素是广泛存在于植物中的一类芳香族化合物,具有抗菌和消炎作用.它的核心结构是芳香内酯,其结构简式为
 .
.(1)下列关于芳香内酯的叙述正确的是
BC
BC
.A.分子式为C9H8O2 B.可发生加聚反应
C.能与溴水发生反应 D.1mol芳香内酯最多能和5mol氢气发生加成反应
(2)写出芳香内酯在酸性条件下水解的化学方程式:


(3)芳香内酯经下列步骤可转变为水杨酸等物质:

提示:CH3CH=CHCH2CH3
| ①KMnO4、OH- | ②H30+ |
请回答下列问题:
①指出D→F的反应类型为
取代反应
取代反应
.②请写出反应C→E的化学方程式:


③在一定条件下阿司匹林(
 )可由水杨酸制得.下列可检验阿司匹林样品中混有水杨酸的试剂是
)可由水杨酸制得.下列可检验阿司匹林样品中混有水杨酸的试剂是a
a
.a.三氯化铁溶液 b.碳酸氢钠溶液 c.石蕊试液 d.氢氧化钠溶液
④水杨酸的同分异构体中含有酚羟基且属于酯类的共有3种,写出其中一种同分异构体的结构简式


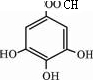
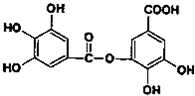 、以五倍子为原料可制得A,A的结构简式如图所示,试回答下列问题:
、以五倍子为原料可制得A,A的结构简式如图所示,试回答下列问题:(1)A的分子式为
C14H10O9
C14H10O9
.(2)有机化合物B在硫酸催化条件下加热发生酯化反应可得到A,写出B与过量NaOH溶液反应的化学方程式
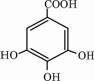 +4NaOH→
+4NaOH→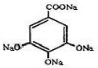 +4H2O
+4H2O +4NaOH→
+4NaOH→ +4H2O
+4H2O(3)写出同时满足以下各条件的B的所有同分异构体的结构简式,①苯环上有四个取代基,②苯环上的一取代物只有一种,③1molB与足量的金属钠反应,生成1.5mol氢气

(2012?岳阳二模)如图是合成氨和利用氨制取硝酸、纯碱的简要流程示意图:
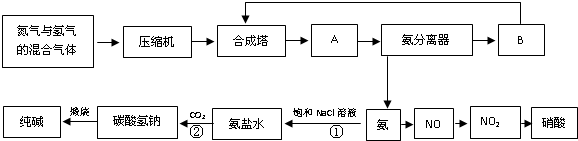
(1)设备A的名称是
(2)有关合成氨工业的说法中,正确的是
A.从合成塔出来的混合气体,其中NH3只占15%,所以生产氨的工厂的效率都很低
B.由于氨易液化,N2、H2是循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是2×107~5×107Pa,因在该压强下铁触媒的活性最大
(3)在纯碱制造过程中,过程①与过程②的顺序能否颠倒?
(4)硝酸厂的尾气中含有NO和NO2等污染物,常利用各种燃料气中的甲烷等将氮的氧化物还原为空气主要成分而除去.写出甲烷与NO2反应的化学反应方程式:
若基于下列反应的方法治理:2NO2+2NaOH→NaNO3+NaNO2+H2O,NO+NO2+2NaOH→2NaNO2+H2O;现有标准状况下NO、NO2的混合物恰好与50mL 2.0mol?L-1的NaOH溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO气体的体积分数为
查看习题详情和答案>>

(1)设备A的名称是
冷凝器
冷凝器
,设备B的名称是循环压缩机
循环压缩机
.(2)有关合成氨工业的说法中,正确的是
B
B
.A.从合成塔出来的混合气体,其中NH3只占15%,所以生产氨的工厂的效率都很低
B.由于氨易液化,N2、H2是循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是2×107~5×107Pa,因在该压强下铁触媒的活性最大
(3)在纯碱制造过程中,过程①与过程②的顺序能否颠倒?
不能
不能
,其理由是因为CO2在水中溶解度较小,顺序颠倒后得不到较高浓度的HCO3-,所以没有NaHCO3生成
因为CO2在水中溶解度较小,顺序颠倒后得不到较高浓度的HCO3-,所以没有NaHCO3生成
.若产品纯碱中含有碳酸氢钠,用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:ω (NaHCO3)=
| 84(m1-m2) |
| 31m1 |
ω (NaHCO3)=
(注明你的表达式中所用的有关符号的含义)| 84(m1-m2) |
| 31m1 |
(4)硝酸厂的尾气中含有NO和NO2等污染物,常利用各种燃料气中的甲烷等将氮的氧化物还原为空气主要成分而除去.写出甲烷与NO2反应的化学反应方程式:
CH4+2NO2═N2+CO2+2H2O
CH4+2NO2═N2+CO2+2H2O
.若基于下列反应的方法治理:2NO2+2NaOH→NaNO3+NaNO2+H2O,NO+NO2+2NaOH→2NaNO2+H2O;现有标准状况下NO、NO2的混合物恰好与50mL 2.0mol?L-1的NaOH溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO气体的体积分数为
0.3
0.3
.