题目内容
(2012?岳阳二模)如图是合成氨和利用氨制取硝酸、纯碱的简要流程示意图:
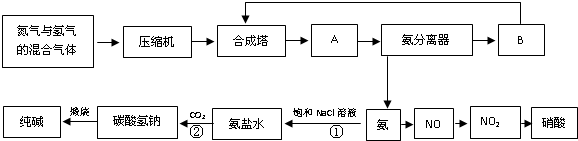
(1)设备A的名称是
(2)有关合成氨工业的说法中,正确的是
A.从合成塔出来的混合气体,其中NH3只占15%,所以生产氨的工厂的效率都很低
B.由于氨易液化,N2、H2是循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是2×107~5×107Pa,因在该压强下铁触媒的活性最大
(3)在纯碱制造过程中,过程①与过程②的顺序能否颠倒?
(4)硝酸厂的尾气中含有NO和NO2等污染物,常利用各种燃料气中的甲烷等将氮的氧化物还原为空气主要成分而除去.写出甲烷与NO2反应的化学反应方程式:
若基于下列反应的方法治理:2NO2+2NaOH→NaNO3+NaNO2+H2O,NO+NO2+2NaOH→2NaNO2+H2O;现有标准状况下NO、NO2的混合物恰好与50mL 2.0mol?L-1的NaOH溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO气体的体积分数为

(1)设备A的名称是
冷凝器
冷凝器
,设备B的名称是循环压缩机
循环压缩机
.(2)有关合成氨工业的说法中,正确的是
B
B
.A.从合成塔出来的混合气体,其中NH3只占15%,所以生产氨的工厂的效率都很低
B.由于氨易液化,N2、H2是循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是2×107~5×107Pa,因在该压强下铁触媒的活性最大
(3)在纯碱制造过程中,过程①与过程②的顺序能否颠倒?
不能
不能
,其理由是因为CO2在水中溶解度较小,顺序颠倒后得不到较高浓度的HCO3-,所以没有NaHCO3生成
因为CO2在水中溶解度较小,顺序颠倒后得不到较高浓度的HCO3-,所以没有NaHCO3生成
.若产品纯碱中含有碳酸氢钠,用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:ω (NaHCO3)=
| 84(m1-m2) |
| 31m1 |
ω (NaHCO3)=
(注明你的表达式中所用的有关符号的含义)| 84(m1-m2) |
| 31m1 |
(4)硝酸厂的尾气中含有NO和NO2等污染物,常利用各种燃料气中的甲烷等将氮的氧化物还原为空气主要成分而除去.写出甲烷与NO2反应的化学反应方程式:
CH4+2NO2═N2+CO2+2H2O
CH4+2NO2═N2+CO2+2H2O
.若基于下列反应的方法治理:2NO2+2NaOH→NaNO3+NaNO2+H2O,NO+NO2+2NaOH→2NaNO2+H2O;现有标准状况下NO、NO2的混合物恰好与50mL 2.0mol?L-1的NaOH溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO气体的体积分数为
0.3
0.3
.分析:(1)根据图示的流程及合成氨的条件分析完成;
(2)A、通过循环利用提高了生产氨的工厂的效率;
B、合成氨中,先将氨气液化,然后循环利用氮气、氢气,提高了合成氨产率;
C、合成氨反应温度控制在500℃左右,在该温度下反应速率较快、催化剂活性较高;
D、根据压强对合成氨的影响分析;
(3)根据二氧化碳的溶解度分析;利用差量法计算出纯碱中碳酸氢钠的质量分数;
(4)根据反应物为甲烷和二氧化氮,生成物为氮气和二氧化碳写成反应的方程式;NO、NO2的物质的量分别为xmol、ymol,利用反应的化学方程式解答.
(2)A、通过循环利用提高了生产氨的工厂的效率;
B、合成氨中,先将氨气液化,然后循环利用氮气、氢气,提高了合成氨产率;
C、合成氨反应温度控制在500℃左右,在该温度下反应速率较快、催化剂活性较高;
D、根据压强对合成氨的影响分析;
(3)根据二氧化碳的溶解度分析;利用差量法计算出纯碱中碳酸氢钠的质量分数;
(4)根据反应物为甲烷和二氧化氮,生成物为氮气和二氧化碳写成反应的方程式;NO、NO2的物质的量分别为xmol、ymol,利用反应的化学方程式解答.
解答:解:(1)从合成塔出来的氨气温度较高,需要降低温度,然后分离,所以装置A为冷凝器;分离出氨气后的氮气、氢气需要循环利用,通过循环压缩机增大压强,输送到合成塔中循环利用,
故答案为:冷凝器;循环压缩机;
(2)A.从合成塔出来的混合气体,其中NH3只占15%,通过循环使用氮气和氢气,大大提高了氨气的产率,故A错误;
B.由于氨易液化,分离出氨气,通过N2、H2的循环使用,大大提高了氨的产率,故B正确;
C.该反应正反应是放热反应,高温不利用氨气的合成,合成氨反应温度控制在500℃左右,在该温度下反应速率较快、催化剂活性较高,故C错误;
D.合成氨是可逆反应,增大压强,平衡向着使压强减小的方向移动,有利于生成氨气,提高原料的利用率,故D错误;
故选B;
(3)由于CO2在水中溶解度较小,过程①与过程②的顺序颠倒后得不到较高浓度的HCO3-,所以没有NaHCO3生成;
设混合物加热前质量为m1,加热后质量为m2,质量计算为:(m1-m2),
碳酸氢钠加热分解的方程式为:2NaHCO3
CO2↑+Na2CO3+H2O△m
168g 44g 18g 62g
m(NaHCO3) (m1-m2)
混合物中碳酸氢钠的质量为:m(NaHCO3)=
=
,
碳酸氢钠的质量分数为:ω (NaHCO3)=
=
,
故答案为:不能;因为CO2在水中溶解度较小,顺序颠倒后得不到较高浓度的HCO3-,所以没有NaHCO3生成;ω (NaHCO3)=
;
(4)根据题中信息,反应物为甲烷和二氧化氮,生成为氮气和二氧化碳,根据化合价升降相等配平,反应的化学方程式为:CH4+2NO2═N2+CO2+2H2O,
NO、NO2的物质的量分别为xmol、ymol,
根据反应NO2+NO+2NaOH→2NaNO2+H2O
1 1 2
x x 2x
2NO2 +2NaOH→NaNO2+NaNO3+H2O
2 1 1
(y-x) 0.5(y-x) 0.5(y-x)
所以[2x+0.5(y-x)]:0.5(y-x)=4:1,
解得x:y=3:7,
则NO的体积分数为:
=0.3,
故答案为:CH4+2NO2═N2+CO2+2H2O;0.3.
故答案为:冷凝器;循环压缩机;
(2)A.从合成塔出来的混合气体,其中NH3只占15%,通过循环使用氮气和氢气,大大提高了氨气的产率,故A错误;
B.由于氨易液化,分离出氨气,通过N2、H2的循环使用,大大提高了氨的产率,故B正确;
C.该反应正反应是放热反应,高温不利用氨气的合成,合成氨反应温度控制在500℃左右,在该温度下反应速率较快、催化剂活性较高,故C错误;
D.合成氨是可逆反应,增大压强,平衡向着使压强减小的方向移动,有利于生成氨气,提高原料的利用率,故D错误;
故选B;
(3)由于CO2在水中溶解度较小,过程①与过程②的顺序颠倒后得不到较高浓度的HCO3-,所以没有NaHCO3生成;
设混合物加热前质量为m1,加热后质量为m2,质量计算为:(m1-m2),
碳酸氢钠加热分解的方程式为:2NaHCO3
| ||
168g 44g 18g 62g
m(NaHCO3) (m1-m2)
混合物中碳酸氢钠的质量为:m(NaHCO3)=
| 168×(m1-m2) |
| 62 |
| 84(m1-m2) |
| 31 |
碳酸氢钠的质量分数为:ω (NaHCO3)=
| ||
| m1 |
| 84(m1-m2) |
| 31m1 |
故答案为:不能;因为CO2在水中溶解度较小,顺序颠倒后得不到较高浓度的HCO3-,所以没有NaHCO3生成;ω (NaHCO3)=
| 84(m1-m2) |
| 31m1 |
(4)根据题中信息,反应物为甲烷和二氧化氮,生成为氮气和二氧化碳,根据化合价升降相等配平,反应的化学方程式为:CH4+2NO2═N2+CO2+2H2O,
NO、NO2的物质的量分别为xmol、ymol,
根据反应NO2+NO+2NaOH→2NaNO2+H2O
1 1 2
x x 2x
2NO2 +2NaOH→NaNO2+NaNO3+H2O
2 1 1
(y-x) 0.5(y-x) 0.5(y-x)
所以[2x+0.5(y-x)]:0.5(y-x)=4:1,
解得x:y=3:7,
则NO的体积分数为:
| 3 |
| 3+7 |
故答案为:CH4+2NO2═N2+CO2+2H2O;0.3.
点评:本题考查了合成氨和利用氨制取硝酸、纯碱的方法,涉及的内容较多,难度稍大,充分考查学生的分析、理解能力和灵活应用知识的能力.

练习册系列答案
相关题目
 Ca2++2OH-.加入以下溶液,可使Ca(OH)2减少的是( )
Ca2++2OH-.加入以下溶液,可使Ca(OH)2减少的是( )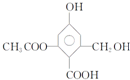 (2012?岳阳二模)已知某有机物X的结构简式如图.下列有关叙述不正确的是( )
(2012?岳阳二模)已知某有机物X的结构简式如图.下列有关叙述不正确的是( )