摘要:19.将3mol/l NaOH溶液滴入到25ml 一定浓度的AlCl3溶液中.下图是整个过程的数学分析曲线.其中横轴表示加入OH-的物质的量.纵轴表示产生的Al(OH)3沉淀的物质的量.椐图示回答下列问题: (1)图中A点表示的意义是: . B点表示的意义是: . (2)当C点从O点向A点运动时.表示随OH-的不断加入.沉淀量逐渐 .OA曲线表示的离子反应是: .由此可得A点的坐标为 ,当C点从A点向B点运动时.表示: .AB曲线表示的离子反应为: .由此可得B点的坐标为: . (3)由上述分析.可求得AlCl3溶液中Al3+离子的浓度为: mol/l. (4)由上可知:生成沉淀的量随加入的OH-的量而改变.可以把它们表示成函数的关系.若以加入的OH-的物质的量x为自变量.以生成的沉淀的物质的量y为因变量.当C点处于OA段时函数表达式为:y= ,当C点处于AB段时函数表达式为:y= . (5)利用上述所得结果.填写下表: 加入NaOH溶液的体积(ml) 5.0 10.0 12.0 产生的Al(OH)3沉淀的质量(g)
网址:http://m.1010jiajiao.com/timu3_id_250083[举报]
将NO、NO2的混合气体缓缓通入盛有10L 0.3mol/L NaOH溶液的烧杯中,恰好被完全吸收,则混合气体中NO、NO2的体积比为( )
(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O,2NaOH+NO2+NO=2NaNO2+H2O)
(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O,2NaOH+NO2+NO=2NaNO2+H2O)
| A、≤1:1 | B、只能等于1:2 | C、只能等于1:1 | D、等于1:3 |
将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO).向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g.则下列叙述中不正确的是( )
| A、当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100mL | B、当金属全部溶解时收集到NO气体的体积一定为2.24L | C、参加反应的金属的总质量为9.6g>m>3.6g | D、当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol |
请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)请完成该反应的化学方程式:(系数按顺序填在答题卷上)
C+ KMnO4+ H2SO4→ CO2↑+ MnSO4+ K2SO4+ H2O
(2)焦炭可用于制取水煤气.测得12g 碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式:
(3)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F,E和F均为空气的组成成分.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
①写出NO与活性炭反应的化学方程式 .
②根据上述信息判断,温度T1和T2的关系是(填序号) .
a.T1>T2 b.T1<T2 c.无法比较
(4)CO2经常用氢氧化钠溶液来吸收,现有0.4molCO2,若用200mL 3mol/L NaOH溶液将其完全吸.回答下列问题:
①所得溶液的溶质是 (填化学式).
②溶液中下列关系正确的是 (填字母序号).
a.c(Na+)>c(CO
)>c(OH-)>c(HCO
)
b.c(Na+)>c(HCO
)>c(CO
)>c(OH-)
c.c(Na+)=2c(CO
)+c(HCO
)+c(H2CO3)
d.c(H+)+c(Na+)=c(OH-)+2c(CO
)+c(HCO
)
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的一定浓度的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为1.9×10-4mol/L,则混合后若生成沉淀所需原CaCl2溶液的最小浓度为 .
查看习题详情和答案>>
(1)请完成该反应的化学方程式:(系数按顺序填在答题卷上)
(2)焦炭可用于制取水煤气.测得12g 碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式:
(3)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F,E和F均为空气的组成成分.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
| 物质 温度 |
活性炭(mol) | NO(mol) | E(mol) | F(mol) |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②根据上述信息判断,温度T1和T2的关系是(填序号)
a.T1>T2 b.T1<T2 c.无法比较
(4)CO2经常用氢氧化钠溶液来吸收,现有0.4molCO2,若用200mL 3mol/L NaOH溶液将其完全吸.回答下列问题:
①所得溶液的溶质是
②溶液中下列关系正确的是
a.c(Na+)>c(CO
2- 3 |
- 3 |
b.c(Na+)>c(HCO
- 3 |
2- 3 |
c.c(Na+)=2c(CO
2- 3 |
- 3 |
d.c(H+)+c(Na+)=c(OH-)+2c(CO
2- 3 |
- 3 |
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的一定浓度的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为1.9×10-4mol/L,则混合后若生成沉淀所需原CaCl2溶液的最小浓度为
(2011?江苏)高氯酸按(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取
NaClO4 (aq)+NH4Cl(aq)
NH4ClO4 (aq)+NaCl(aq)
(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是
(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.15(相关物质的溶解度曲线见图1).从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)
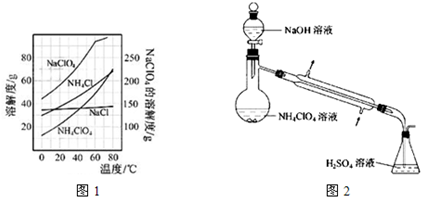
(3)样品中NH4ClO4的含量可用蒸馏法进行测定,蒸馏装置如图2所示(加热和仪器固定装代已略去),实验步骤如下:
步骤1:按图2所示组装仪器,检查装置气密性.
步骤2:准确称取样品a g(约 0.5g)于蒸馏烧瓶中,加入约150mL水溶解.
步骤3:准确量取40.00mL约0.1mol?L-?H2SO4 溶解于锥形瓶中.
步骤4:经滴液漏斗向蒸馏瓶中加入20mL 3mol?L-?NaOH溶液.
步骤5:加热蒸馏至蒸馏烧瓶中神域约100mL溶液.
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中.
步骤7:向锥形瓶中加入酸碱指示剂,用c mol?L-?NaOH标准溶液滴定至终点,消耗NaOH标准溶液v1mL
步骤8:将实验步骤1-7重复2次
①步骤3中,准确量取40.00mlH2SO4溶液的玻璃仪器是
②步骤1-7中确保生成的氨被稀硫酸完全吸收的实验是
③为获得样品中NH4ClO4的含量,还需补充的实验是
查看习题详情和答案>>
NaClO4 (aq)+NH4Cl(aq)
| ||
(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是
氨气与浓盐酸反应放出热量
氨气与浓盐酸反应放出热量
.(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.15(相关物质的溶解度曲线见图1).从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)
蒸发浓缩,冷却结晶,过滤,冰水洗涤
蒸发浓缩,冷却结晶,过滤,冰水洗涤
干燥.
(3)样品中NH4ClO4的含量可用蒸馏法进行测定,蒸馏装置如图2所示(加热和仪器固定装代已略去),实验步骤如下:
步骤1:按图2所示组装仪器,检查装置气密性.
步骤2:准确称取样品a g(约 0.5g)于蒸馏烧瓶中,加入约150mL水溶解.
步骤3:准确量取40.00mL约0.1mol?L-?H2SO4 溶解于锥形瓶中.
步骤4:经滴液漏斗向蒸馏瓶中加入20mL 3mol?L-?NaOH溶液.
步骤5:加热蒸馏至蒸馏烧瓶中神域约100mL溶液.
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中.
步骤7:向锥形瓶中加入酸碱指示剂,用c mol?L-?NaOH标准溶液滴定至终点,消耗NaOH标准溶液v1mL
步骤8:将实验步骤1-7重复2次
①步骤3中,准确量取40.00mlH2SO4溶液的玻璃仪器是
酸式滴定管
酸式滴定管
.②步骤1-7中确保生成的氨被稀硫酸完全吸收的实验是
1,5,6
1,5,6
(填写步骤号).③为获得样品中NH4ClO4的含量,还需补充的实验是
用NaOH标准溶液标定H2SO4溶液的浓度
用NaOH标准溶液标定H2SO4溶液的浓度
.(2010?聊城一模)能源问题是当前世界各国所面临的严重问题,同时全球气候变暖,生态环境问题日益突出,开发氢能、研制燃料电池、发展低碳经济是化学工作者的研究方向.
I.氢气通常用生产水煤气方法制得.其中CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.在850℃时,平衡常数K=1.
(1)若降低温度到750℃时,达到平衡时K
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3mol H2O、1.0mol CO2和x mol H2,则:
①当x=5.0时,上述反应向
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是
③在850℃时,若设x=5.0和x=6.0,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a
II.已知4.6g液态乙醇完全燃烧生成二氧化碳和液态水放出热量136kJ,1mol液态水转化为气体水吸收44kJ的热量.
(3)请写出乙醇燃烧生成气态水的热化学方程式
(4)将0.1mol乙醇在足量氧气中燃烧,得到的气体全部通入到100mL 3mol/L NaOH溶液中,忽略HCO-3的电离,则所得溶液中c(CO2-3)
查看习题详情和答案>>
I.氢气通常用生产水煤气方法制得.其中CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.在850℃时,平衡常数K=1.
(1)若降低温度到750℃时,达到平衡时K
大于
大于
1(填“大于”、“小于”或“等于”)(2)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3mol H2O、1.0mol CO2和x mol H2,则:
①当x=5.0时,上述反应向
逆反应
逆反应
(填“正反应”或“逆反应”)方向进行.②若要使上述反应开始时向正反应方向进行,则x应满足的条件是
x<3
x<3
.③在850℃时,若设x=5.0和x=6.0,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a
小于
小于
b(填“大于”、“小于”或“等于”)II.已知4.6g液态乙醇完全燃烧生成二氧化碳和液态水放出热量136kJ,1mol液态水转化为气体水吸收44kJ的热量.
(3)请写出乙醇燃烧生成气态水的热化学方程式
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1228kJ/mol
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1228kJ/mol
.(4)将0.1mol乙醇在足量氧气中燃烧,得到的气体全部通入到100mL 3mol/L NaOH溶液中,忽略HCO-3的电离,则所得溶液中c(CO2-3)
小于
小于
c(HCO-3)(填“大于”、“小于”或“等于”,)原因是生成的碳酸钠与碳酸氢钠的物质的量相等,CO32-水解程度大于HCO3-水解程度
生成的碳酸钠与碳酸氢钠的物质的量相等,CO32-水解程度大于HCO3-水解程度
(用文字叙述).