网址:http://m.1010jiajiao.com/timu3_id_249841[举报]
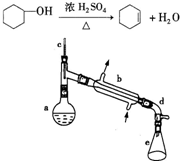 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:| 相对分子质量 | 密度/(g?cm-3) | 沸点/℃ | 溶解性 | |
| 环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是
(2)加入碎瓷片的作用是
A.立即补加
B.冷却后补加
C.不需补加
D.重新配料
(3)本实验中最容易产生的副产物的结构简式为


(4)分液漏斗在使用前须清洗干净并
(5)分离提纯过程中加入无水氯化钙的目的是
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有
A.圆底烧瓶
B.温度计
C.吸滤瓶
D.球形冷凝管
E.接收器
(7)本实验所得到的环己烯产率是
A.41%
B.50%
C.61%
D.70%
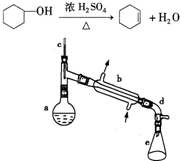 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:
| 相对分子质量 | 密度/(g?cm-3) | 沸点/℃ | 溶解性 | |
| 环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是______.
(2)加入碎瓷片的作用是______;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是______(填正确答案标号).
A.立即补加
B.冷却后补加
C.不需补加
D.重新配料
(3)本实验中最容易产生的副产物的结构简式为______.
(4)分液漏斗在使用前须清洗干净并______;在本实验分离过程中,产物应该从分液漏斗的______(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是______.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有______(填正确答案标号).
A.圆底烧瓶
B.温度计
C.吸滤瓶
D.球形冷凝管
E.接收器
(7)本实验所得到的环己烯产率是______(填正确答案标号).
A.41%
B.50%
C.61%
D.70% 查看习题详情和答案>>
| 相对分子质量 | 密度/ | 沸点/℃ | 溶解性 | |
| 环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是 .
(2)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 (填正确答案标号).
A.立即补加
B.冷却后补加
C.不需补加
D.重新配料
(3)本实验中最容易产生的副产物的结构简式为 .
(4)分液漏斗在使用前须清洗干净并 ;在本实验分离过程中,产物应该从分液漏斗的 (填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是 .
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有 (填正确答案标号).
A.圆底烧瓶
B.温度计
C.吸滤瓶
D.球形冷凝管
E.接收器
(7)本实验所得到的环己烯产率是 (填正确答案标号).
A.41%
B.50%
C.61%
D.70%
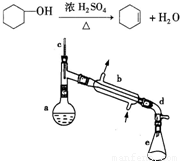 查看习题详情和答案>>
查看习题详情和答案>>
 Ⅰ.铜与稀硝酸反应的离子方程式为
Ⅰ.铜与稀硝酸反应的离子方程式为在做铜与稀硝酸反应的实验时,常观察到试管内生成的气体先为浅红棕色,其原因是
为了能直接观察到生成的气体的颜色,可在往稀硝酸中加入铜的同时,加入少量碳酸盐,那么加入少量碳酸盐的作用是
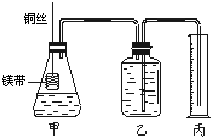
Ⅱ.某研究性学习小组欲证明:在同温同压下,相同浓度、相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如右图所示.该实验的主要操作步骤如下:
①配制浓度均为1mol?L-1盐酸和醋酸溶液;
②量取15.00mL 1mol?L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端;
④在广口瓶中装足量的水,按图连接好装置,检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录相关数据;
⑥反应结束后待温度恢复到室温,调整乙和丙中液面使二者处于同一平面,读出量筒中水的体积为V mL.
请你参与实验并回答下列问题:
(1)量取15.00mL 1mol?L-1盐酸和醋酸溶液所用的仪器是
A.带刻度的烧杯 B.量筒 C.酸式滴定管 D.碱式滴定管
(2)步骤③中a的数值至少是
(3)本实验装置丙中量筒的规格是
A.10mL B.100mL C.200mL D.500mL
(4)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=
(5)试简述速率不等的原因是
(6)试写出镁与醋酸溶液反应的离子方程式:
Ⅰ.(4分)铜与稀硝酸反应的离子方程式为________________;在做铜与稀硝酸反应的实验时,常观察到试管内生成的气体先为浅红棕色,其原因是________________;为了能直接观察到生成的气体的颜色,可在往稀硝酸中加入铜的同时,加入少量碳酸盐,那么加入少量碳酸盐的作用是________________。
Ⅱ.某研究性学习小组欲证明:在同温同压下,相同浓度、相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:

①配制浓度均为1 mol?L-1盐酸和醋酸溶液;
②量取15.00 mL 1 mol?L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端;
④在广口瓶中装足量的水,按图连接好装置,检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录相关数据;
⑥反应结束后待温度恢复到室温,调整乙和丙中液面使二者处于同一平面,读出量筒中水的体积为V mL。
请你参与实验并回答下列问题:
(1)量取15.00 mL 1 mol?L-1盐酸和醋酸溶液所用的仪器是 ;
A.带刻度的烧杯 B.量筒 C.酸式滴定管 D.碱式滴定管
(2)步骤③中a的数值至少是 ;步骤④中检查该装置气密性的操作与观察方法是:____________________;步骤⑤中应记录的数据是 ;
(3)本实验装置丙中量筒的规格是 (填序号)。
A.10mL B.100 mL C.200 mL D.500 mL
(4) 若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=____;
(5)试简述速率不等的原因是_________;铜丝不与酸接触的原因是_______________。
(6)试写出镁与醋酸溶液反应的离子方程式: 。
查看习题详情和答案>>