摘要:㈠.单项选择题 ⒈下列操作不需要用玻璃棒的是( ) A. 过滤 B. 蒸发 C. 配制一定物质的量浓度溶液 D. 萃取 ⒉现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质溴的水溶液.分离以上各混合液的正确方法依次是 A. 蒸馏.萃取.分液 B. 分液.蒸馏.萃取 C. 分液.萃取.蒸馏 D. 萃取.蒸馏.分液 ⒊混合物分离的方法在生产.生活和科学实验中有着广泛的应用.请指出在实际生产.生活中应用分离方法可行的是 a.分离豆浆和豆渣 b.海水制粗盐 c.除去水中的沙子 d.石油提炼汽油 e.从稀溴水中提取溴 A. 都不可行 B. 只有a可行 C. a.c可行 D. b.e可行 ⒋已知丙酮是一种外观像水的无色液体.不溶于水.密度小于水.沸点低于水.要从水与丙酮的混合物中将丙酮分离出来.下列方法最合理的是 A. 蒸馏 B. 分液 C. 过滤 D. 蒸发 ⒌下列实验中:①配制一定物质的量浓度的溶液,②pH试纸的使用,③过滤,④蒸发,⑤溶解.均用到的仪器是 A. 烧杯 B. 漏斗 C. 玻璃棒 D. 胶头滴管 ⒍除去NaCl中含有的Ca2+.Mg2+.SO42―.HCO3―等离子.通常采用以下四种试剂: ①Na2CO3 ②BaCl2 ③NaOH ④HCl .加入试剂合理的操作顺序是 A. ①②③④ B. ③①②④ C. ④②①③ D. ③②①④ ⒎下列物质中.可用于萃取碘水中的碘的是 A. 四氯化碳 B. 水 C. 酒精 D. NaOH固体 ㈡.填空题 如图为实验室制取自来水的装置示意图. 根据图示回答下列问题. ⑴图中的两处明显的错误是 . ⑵A仪器的名称是 .B仪器 的名称是 . ⑶实验时A中除加入少量自来水外. 还需加入少量 .其作用是 .
网址:http://m.1010jiajiao.com/timu3_id_248596[举报]
(Ⅰ)多项选择题
下列关于化工生产的叙述正确的是 .
A.炼钢就是在高炉中用还原剂把铁从铁矿石中还原出来
B.离子交换膜法制碱工业中,氢氧化钠在电解槽的阴极区产生
C.工业制硫酸中,三氧化硫是在吸收塔内用98%的硫酸吸收
D.黏土是生产陶瓷、玻璃和水泥的共同原料
(Ⅱ)氨是重要的无机化工产品之一,在国民经济中占有重要地位.世界上的氨除少量从焦炉气中回收副产外,绝大部分是合成的氨.海南岛的南海北部湾莺歌海海域有着丰富的天然气气田,利用此资源在东方市八所港建有一家大型的合成氨化肥厂.
(1)写出该化肥厂生产H2的化学反应方程式 .
(2)在硫酸的工业生产中,往往会增大O2的比例来提高SO2的转化率,在合成氨生产中是否会采用相同的方法,请说明理由. .
(3)在制取原料气体的过程中,常混有一些杂质,在进入合成塔之前必须将杂质除去,原因是 .例如除去CO是先将其氧化成CO2,然后常用 吸收.
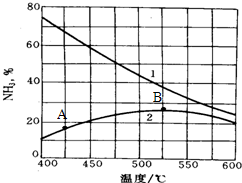
(4)下图是氨的产率与温度的关系,曲线1表示平衡时氨的产率,曲线2表示反应进行一段时间但还未达到平衡时氨的含量.请分析A点氨的含量小于B的原因 .在实际生产中,温度往往采用500℃而不用400℃的原因是 .
(5)在合成氨的生产过程中会产生大量CO2,该化肥厂与俄罗斯塔氏集团合作,利用这些CO2建设一个年产52万吨的小颗粒尿素加工厂,再进一步加工成氮磷钾复合肥,请写出该合成尿素反应的化学方程式 ,请写出该设计的优点 .
查看习题详情和答案>>
下列关于化工生产的叙述正确的是
A.炼钢就是在高炉中用还原剂把铁从铁矿石中还原出来
B.离子交换膜法制碱工业中,氢氧化钠在电解槽的阴极区产生
C.工业制硫酸中,三氧化硫是在吸收塔内用98%的硫酸吸收
D.黏土是生产陶瓷、玻璃和水泥的共同原料
(Ⅱ)氨是重要的无机化工产品之一,在国民经济中占有重要地位.世界上的氨除少量从焦炉气中回收副产外,绝大部分是合成的氨.海南岛的南海北部湾莺歌海海域有着丰富的天然气气田,利用此资源在东方市八所港建有一家大型的合成氨化肥厂.
(1)写出该化肥厂生产H2的化学反应方程式
(2)在硫酸的工业生产中,往往会增大O2的比例来提高SO2的转化率,在合成氨生产中是否会采用相同的方法,请说明理由.
(3)在制取原料气体的过程中,常混有一些杂质,在进入合成塔之前必须将杂质除去,原因是
(4)下图是氨的产率与温度的关系,曲线1表示平衡时氨的产率,曲线2表示反应进行一段时间但还未达到平衡时氨的含量.请分析A点氨的含量小于B的原因

(5)在合成氨的生产过程中会产生大量CO2,该化肥厂与俄罗斯塔氏集团合作,利用这些CO2建设一个年产52万吨的小颗粒尿素加工厂,再进一步加工成氮磷钾复合肥,请写出该合成尿素反应的化学方程式
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答下列问题:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答下列问题:(1)该硫酸的物质的量浓度为
18.4
18.4
mol/L.(2)配制250mL 0.92mol?L-1的稀硫酸需取该硫酸
12.5
12.5
mL.(3)配制时必需的玻璃仪器有:
玻璃棒、烧杯、量筒、胶头滴管、250mL容量瓶
玻璃棒、烧杯、量筒、胶头滴管、250mL容量瓶
(4)定容时,待容量瓶中溶液的凹液面正好与刻度线相切,盖好瓶塞后的下一步操作是
倒转反复摇匀
倒转反复摇匀
.(5)定容时,若加入的水超过刻度线,必须采取的措施是
重新配制
重新配制
(6)下列操作对H2SO4的物质的量浓度有什么影响(偏高、偏低或无影响)?
①转移溶液后,未洗涤烧杯:
偏低
偏低
;②容量瓶用水洗净后未烘干:无影响
无影响
;③定容时俯视容量瓶的刻度线:偏高
偏高
.(I)多项选择题
下列有关化工生产的说法中不正确的是
A.工业上用电解熔融的氯化物的方法制备金属镁和铝
B.适当提高合成氨原料气中N2的含量,可提高H2的转化率
C.从安全运输上看,硫酸厂靠近硫酸消费中心比靠近原料产地更为有利
D.利用反应NaCl(饱和)+CO2+NH3+H2O=NH4Cl+NaHCO3↓制取NaHCO3时,应在NaCl饱和溶液中先通入过量CO2再通入过量的NH3
E.硫酸厂生产时常采有高压条件提高SO2的转化率
(II)
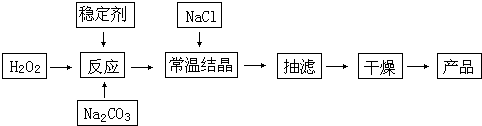
过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,被大量用于洗涤、印染、纺织、造纸、医药卫生等领域中.它的制备原理和路线如下:
试回答下列问题:
(1)与过碳酸钠的用途相关的化学性质是
A.MnO2 B. H2S C.稀硫酸 D. NaHCO3
(2)加入NaCl的作用是
(3)工业纯碱中含有Fe3+等杂质,加入稳定剂的作用是与生成稳定的配合物.Fe3+的不良影响是
(4)反应的最佳温度控制在15~25℃,温度偏高时造成产率偏低的可能原因是
(5)有人想用过碳酸钠测定氢溴酸的浓度.若一定量的过碳酸钠与100mL氢溴酸溶液恰好完全反应,在标准状况下产生448mL气体,则所用氢溴酸的浓度为
查看习题详情和答案>>
下列有关化工生产的说法中不正确的是
ADE
ADE
A.工业上用电解熔融的氯化物的方法制备金属镁和铝
B.适当提高合成氨原料气中N2的含量,可提高H2的转化率
C.从安全运输上看,硫酸厂靠近硫酸消费中心比靠近原料产地更为有利
D.利用反应NaCl(饱和)+CO2+NH3+H2O=NH4Cl+NaHCO3↓制取NaHCO3时,应在NaCl饱和溶液中先通入过量CO2再通入过量的NH3
E.硫酸厂生产时常采有高压条件提高SO2的转化率
(II)
过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,被大量用于洗涤、印染、纺织、造纸、医药卫生等领域中.它的制备原理和路线如下:

试回答下列问题:
(1)与过碳酸钠的用途相关的化学性质是
强氧化性
强氧化性
,下列四种物质可使过碳酸钠较快失效的是ABC
ABC
A.MnO2 B. H2S C.稀硫酸 D. NaHCO3
(2)加入NaCl的作用是
降低2Na2CO3?3H2O2溶解度,析出更多晶体
降低2Na2CO3?3H2O2溶解度,析出更多晶体
(3)工业纯碱中含有Fe3+等杂质,加入稳定剂的作用是与生成稳定的配合物.Fe3+的不良影响是
催化双氧水的分解
催化双氧水的分解
,反应方程式为2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(4)反应的最佳温度控制在15~25℃,温度偏高时造成产率偏低的可能原因是
温度高时双氧水易分解
温度高时双氧水易分解
,温度偏低时造成产率偏低的可能原因是温度低时反应慢
温度低时反应慢
,而该流程中还是遗漏了一步操作,造成产品产率偏低,这步操作名称是洗涤
洗涤
.(5)有人想用过碳酸钠测定氢溴酸的浓度.若一定量的过碳酸钠与100mL氢溴酸溶液恰好完全反应,在标准状况下产生448mL气体,则所用氢溴酸的浓度为
1
1
mol/L.(已知:H2O2+2HBr=Br2+2H2O)(2010?天津)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.制备纳米TiO2的方法之一是TiCl4水解生成TiO2?x H2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用现代分析仪器测定TiO2粒子的大小.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
请回答下列问题:
(1)TiCl4水解生成TiO2?x H2O的化学方程式为
(2)检验TiO2?x H2O中Cl-是否被除净的方法是
(3)下列可用于测定TiO2粒子大小的方法是
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
(4)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是
(5)滴定终点的现象是
(6)滴定分析时,称取TiO2(摩尔质量为M g?mol-1)试样w g,消耗c mol?L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为
(或
%)
(或
%).
(7)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果
查看习题详情和答案>>
请回答下列问题:
(1)TiCl4水解生成TiO2?x H2O的化学方程式为
TiCl4+(x+2)H2O TiO2?xH2O↓+4HCl
TiO2?xH2O↓+4HCl
 TiO2?xH2O↓+4HCl
TiO2?xH2O↓+4HClTiCl4+(x+2)H2O TiO2?xH2O↓+4HCl
TiO2?xH2O↓+4HCl
. TiO2?xH2O↓+4HCl
TiO2?xH2O↓+4HCl(2)检验TiO2?x H2O中Cl-是否被除净的方法是
取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净
取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净
.(3)下列可用于测定TiO2粒子大小的方法是
d
d
(填字母代号).a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
(4)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是
抑制NH4Fe(SO4)2水解
抑制NH4Fe(SO4)2水解
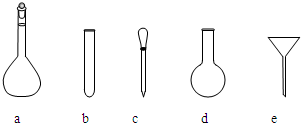
;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要图中的a、c
a、c
(填字母代号).
(5)滴定终点的现象是
溶液变为红色
溶液变为红色
.(6)滴定分析时,称取TiO2(摩尔质量为M g?mol-1)试样w g,消耗c mol?L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为
| cVM |
| 1000w |
| cVM |
| 10w |
| cVM |
| 1000w |
| cVM |
| 10w |
(7)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果
偏高
偏高
.②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果
偏低
偏低
.如图为实验室某试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
| 氢氧化钠溶液 分子式:NaOH 相对分子质量:40 密度:1.2g?cm-3 质量分数:20%(1)该NaOH溶液的物质的量浓度为 6 6 mol/L.(2)现在要配制该浓度的NaOH溶液100ml,需称量 24.0 24.0 g固体氢氧化钠.溶液配制的所需的基本步骤如下: (3)将上述实验步骤A到F按实验过程先后次序排列 CBDFAE CBDFAE .(4)上述实验步骤A、B、E、F都用到的仪器名称为 100ml容量瓶 100ml容量瓶 .(5)下列操作对NaOH溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”). ①摇匀后发现液面低于刻度线再加水 偏低 偏低 ;②容量瓶中原有少量蒸馏水 无影响 无影响 ;③定容时俯视观察液面 偏高 偏高 .
查看习题详情和答案>>
|