摘要:21.某温度下在1L密闭容器中加入1molN2和3molH2.使反应N2+3H2=====2NH3达平衡.测得平衡混合气中N2.H2.NH3浓度分别为M.N.Gmol·L-1.如果保持温度不变.只改变最初物质的加入量.而要求M.N.G总保持不变.则N2.H2.NH3的加入量用x.y.z表示时.应满足的条件是: (1) 若x=0.y=0.则z= (2) 若x=0.75mol.则y= .z= .
网址:http://m.1010jiajiao.com/timu3_id_247314[举报]
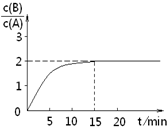 已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)═B(g)+C(g);△H=-48.25kJ?mol-1
反应过程中时间t与A、B浓度有如图关系,若测得第15min时
c(B)=1.6mol?L-1,则下列结论正确的是( )
| A、反应在前15min的平均速率ν(A)=0.11 mol?L-1?min-1 | B、A的初始物质的量为8 mol | C、反应到达平衡的过程中,放出的热量是77.2kJ | D、如使反应最终c(B)/c(A)=1.5,恒温恒容时,加入一定量的A可以实现 |
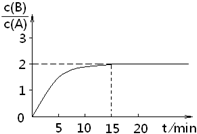 已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)?B(g)+C(g);△H=-48.25kJ?mol-1反应过程中时间t与A、B浓度有下图所示关系,若测得第15min时c(B)=1.6mol?L-1,则下列结论正确的是( )
| A、该温度下此反应平衡常数为3.2 | B、A的初始物质的量为4 mol | C、反应到达平衡的过程中,放出的热量是154.4kJ | D、如使反应最终c(B)/c(A)=3,只能降低反应温度 |
某温度下在,密闭容器中发生如下可逆反应:2M(g)+N(g) 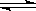 2E(g),若开始时只充入2 mol
E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了
2E(g),若开始时只充入2 mol
E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了
A.20% B.40%C.60% D.80%
查看习题详情和答案>>
 2E(g),若开始时只充入2 mol
E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了
2E(g),若开始时只充入2 mol
E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了  2SO3进行一段时间后SO3的物质的量增加了0.4 mol ,在这段时间内用O2表示的反应速率为0.4 mol·L-1·s-1,则这段时间为( )
2SO3进行一段时间后SO3的物质的量增加了0.4 mol ,在这段时间内用O2表示的反应速率为0.4 mol·L-1·s-1,则这段时间为( )